Электрофильные реакции
Электрофильной называется реакция, в которой молекула органического вещества подвергается действию электрофильного реагента.
Электрофильные ("любящие электроны") реагенты или электрофилы – это частицы (катионы или молекулы), имеющие свободную орбиталь на внешнем электронном уровне.
Примеры электрофильных частиц: H+, CH3+ и другие карбокатионы,
NO2+, ZnCl2, AlCl3.Незаполненность внешнего электронного уровня в электрофильной молекуле показана на примере AlCl3
 .
.
 CH3CH2Cl (электрофил – H+ в составе HCl)
CH3CH2Cl (электрофил – H+ в составе HCl)1. CH2=CH2 + Hδ+— Clδ-
 [(CH2CH2)H]+ + Cl – (быстро)
[(CH2CH2)H]+ + Cl – (быстро)
2. [(CH2CH2)H]+
 CH3CH2+ (медленно)
CH3CH2+ (медленно)
3. CH3CH2+ + Cl –
 CH3CH2Cl (быстро)
CH3CH2Cl (быстро)
-
Схема механизма
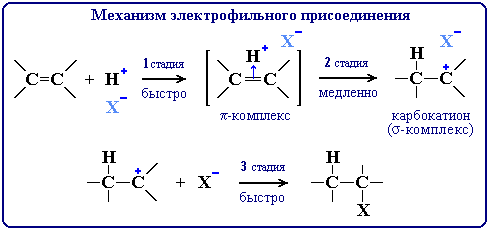
- Интерактивная анимация
Механизм электрофильного присоединения обозначается символом AdE
(по первым буквам английских терминов: Ad – Addition [присоединение], E – Electrophile [электрофил]).
(по первым буквам английских терминов: Ad – Addition [присоединение], E – Electrophile [электрофил]).
 C6H5NO2 + H+ (электрофил – NO2+)
C6H5NO2 + H+ (электрофил – NO2+)Катион NO2+ образуется в смеси конц. кислот HNO3 и H2SO4.
-
Схема механизма
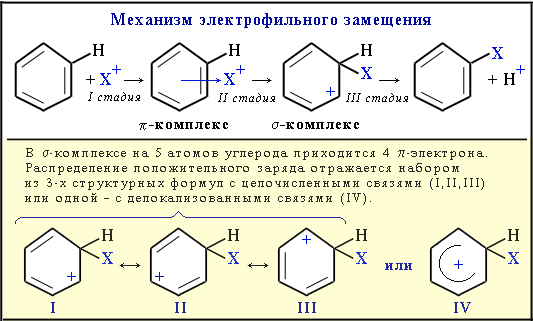
- Интерактивная анимация
Обозначение механизма электрофильного замещения - SE (S – Substitution [замещение], E – Electrophile [электрофил]).








