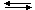 H+ + HSO4–
H+ + HSO4–
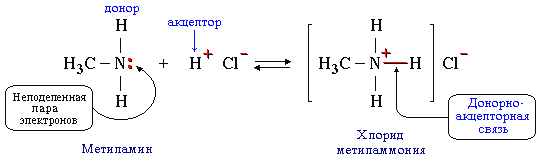
- Разновидностью донорно-акцепторной связи является семиполярная связь
Сeмипoлярная связь образуется при взаимодействии атома-донора пары электронов и атома-акцептора, не имеющих формальных зарядов. При этом на атоме-доноре возникает положительный заряд, а на атоме-акцепторе, предоставившем вакантную орбиталь, – отрицательный.
Например, семиполярная связь O—Al образуется при реакции диметилового эфира (CH3)2O с хлоридом алюминия: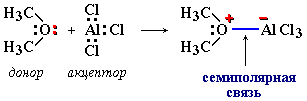
Атом кислорода в молекуле диметилового эфира (CH3)2O отдает свою неподеленную пару электронов для образования связи с атомом алюминия, имеющим во внешнем слое только 6 электронов и готовым его дополнить до 8 в соответствии с правилом октета. В результате на атоме кислорода появляется положительный заряд, а на атоме алюминия – отрицательный. Противоположные по знаку заряды на ковалентно-связанных атомах вызывают их дополнительное электростатическое притяжение (ионную связь).
-
• Сочетание ковалентной и ионной связей называют сeмиполярной связью.
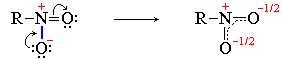
К семиполярным связям относится также связь азот-кислород в нитрогруппе NO2, входящей в состав азотной кислоты HO–NO2, ее солей и эфиров, а также нитросоединений R–NO2:
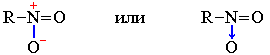
В приведенных формулах нитросоединения связи азота с кислородом неравноценны. Однако, как показывают результаты физических исследований, эти связи энергетически совершенно одинаковы. Следовательно, электронная пара, обусловливающая отрицательный заряд, не сосредоточена целиком на каком-либо одном кислородном атоме, а несколько смещена к азоту при одновременном смещении от азота ко второму кислородному атому подвижной π-электронной пары двойной связи. В результате выравнивания электронной плотности в нитрогруппе формальный отрицательный заряд
(-1) распределяется поровну(-1/2) между обоими атоми кислорода: