Положение элемента в Периодической системе определяет число и тип атомных орбиталей атома, отличающихся энергией, степенью удаления от ядра, формой и пространственной направленностью (обозн.
 | |||
| s-орбиталь | py-орбиталь | dxy-орбиталь | dx2-орбиталь |

r — радиус-вектор; Θ (тета) — угол между радиус-вектором и осью z; φ (фи) — угол между проекцией радиус-вектора на плоскость xy и осью x (x, y, z — декартовы координаты).
координатах:Каждое конкретное решение уравнения Шрёдингера (Ψnℓm), отражающее состояние электрона в атоме, определяется набором констант — квантовых чисел: n (главное), ℓ (орбитальное), m (магнитное). Точное решение волнового уравнения найдено для атома водорода. В остальных случаях получают приближенные результаты.
- * Квантовые числа
ℓ – Орбитальное (азимутальное или побочное) квантовое число – характеризует форму орбитали и подуровень энергетического уровня, задаваемого главным квантовым числом n; ℓ принимает целочисленные значения от 0 до
s (sharp) — резкая,
p (principal)— главная,
d (diffuse) — диффузная,
f (fundamental) — фундаментальная,
g и далее — по алфавиту., используемые в обозначении энергетических подуровней и атомных орбиталей:
| ℓ = 0 1 2 3 4 ... |
| ℓ = s p d f g ... |
Описание орбитали содержит цифру (число n – номер энергетического уровня) и букву, соответствующую числу ℓ (энергетический подуровень).
Например, 2р – это орбиталь при n = 2 (второй энергетический уровень) и ℓ = 1 (р-подуровень).
Каждому значению ℓ соответствует атомная орбиталь характерной формыГеометрическая форма атомной орбитали определяется амплитудой волновой функции электрона в атоме. :
-
s-орбиталь (ℓ = 0) имеет форму сферического слоя,Форма s-АО

а – 3D-модель; б – плоскость среза АО;
• – ядро атома. внутрений и внешний диаметры которого увеличиваются с увеличением главного квантового числа n;
p-орбитали (ℓ = 1) соответствует форма объёмной восьмёрки: два лепестка, разделённые узловой плоскостью (схема);Схематическое изображение p-АО
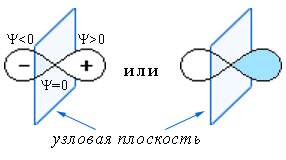
Орбитали d, f, g и т.д. имеют более сложные геометрические формы.
С увеличением ℓ повышается энергия подуровняЧисло ℓ определяет наличие узловых поверхностей в волновой Ψ-функции, которые повышают энергию орбитали. Чем выше ℓ, тем больше узлов и тем выше энергия орбиталей данного подуровня. (в пределах одного энергетического уровня n): s < p < d < f и т.д.
m (mℓ) – Магнитное квантовое число – определяет ориентацию орбитали в пространстве относительно внешнего магнитного или электрического поля. Его значения изменяются от +ℓ до –ℓ, включая 0, то есть m = 2ℓ + 1.Например, при ℓ = 1 число m принимает 3 значения: +1, 0, –1, поэтому существуют три р-АО:
 рx, рy, рz, ориентированных по осям x, y, z, соответственно.
Значению ℓ = 2 соответствуют пять d-орбиталей, а при ℓ = 3 – семь f-орбиталей.
рx, рy, рz, ориентированных по осям x, y, z, соответственно.
Значению ℓ = 2 соответствуют пять d-орбиталей, а при ℓ = 3 – семь f-орбиталей.Спиновое квантовое число s (ms) характеризует не орбиталь, а свойство самого электрона (в уравнении Шрёдингера не учитывается). Спиновое число
может принимать лишь два возможных значения +1/2 и  и
и  .
.
Элементы 1-го периода (Н, He) имеют одну АО на первом энергетическом уровне – 1s.
В элементах 2-го периода электроны занимают пять АО на двух энергетических уровнях: первый уровень 1s; второй уровень – 2s, 2px, 2py, 2pz (цифры обозначают номер энергетического уровня, буквы – форму орбитали).

Иллюстрация
Органические соединения состоят в основном из элементов 2-го и 3-го периодов, внешние (валентные) электроны которых находятся на s- и p-АО. Атомные орбитали s-типа имеет сферическую форму, p-АО – форму объемной восьмерки (гантели), направленной по оси x, y или z.

- Энергия орбитали возрастает по мере удаления электрона от ядра атома, то есть с увеличением номера электронного уровня, который характеризуется главным квантовым числом n.
Аналогично изменяется энергия р-АО: 2p < 3p < 4p и т.д.
Внутри одного энергетического уровня энергия АО возрастает от s-АО к р-АО:








