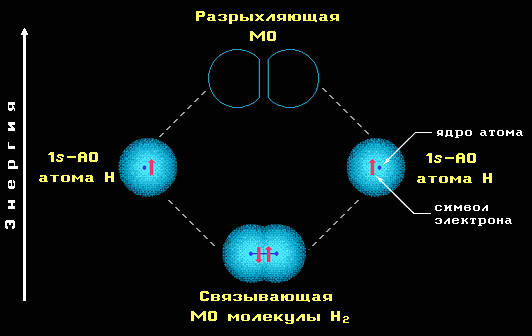
Энергия молекулярных орбиталей
По уровню энергии молекулярные орбитали подразделяются на три типа:- связывающие (СМО), энергия которых ниже энергии исходных АО; нахождение электронов на СМО уменьшает общую энергию молекулы и определяет связывание атомов - химическую связь;
- разрыхляющие (РМО), энергия которых выше, чем у исходных АО; в невозбужденном состоянии молекулы ее РМО вакантны, но в ходе реакции эти орбитали могут принимать 1 или 2 электрона;
- несвязывающие (НСМО), энергия которых равна энергии АО. Несвязывающие МО в основном остаются атомными и на них могут размещаться неподеленные электронные пары (n-электроны) или неспаренные электроны.
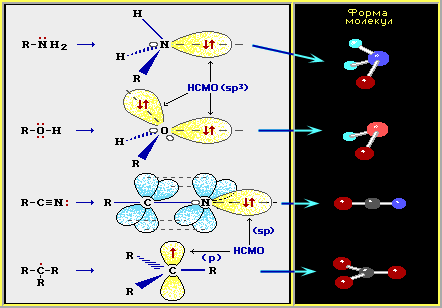
Несвязывающие МО сохраняют форму и энергию исходных атомных орбиталей. Электроны на НСМО, не участвуя в образовании связи, влияют на форму молекулы.