sp-Гибридизация (линейная)
Одна s- и одна р-орбиталь смешиваются, образуя две равноценные sp-орбитали, расположенные под углом 180°, т.е. на одной оси.


VRML-модель
Для элементов 2-го периода sp-гибридизация происходит по схеме:
2py- и 2pz-АО не изменяются.

Схема sp-гибридизации

Например, sp-атом углерода

Строение молекул с sp-атомами отражают их модели:

sp-Гибридизованное состояние свойственно атому, если сумма числа связанных с ним атомов и числа его неподеленных электронных пар равна 2 (примеры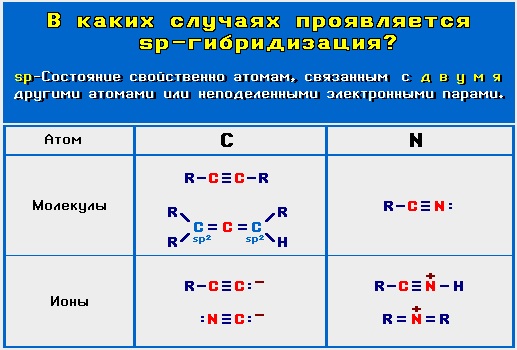 ).
).
Углерод в sp-гибридном состоянии присутствует:
 ).
).- в соединениях с тройной связью

- в соединениях типа R2C=C=CR2, RCH=C=CHR
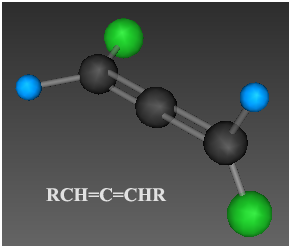 (алленах), VRML-модель;
(алленах), VRML-модель; - в простом веществе карбине, cтроение которого представляют формулами:

ПодробнееКарбин — кристаллическая модификация углерода с цепочечным строением молекул, которые имеют либо полииновое строение(–C≡C–), либо поликумуленовое (=C=C=). Получен искусственно окислительной дегидрополиконденсацией ацетилена, действием лазерного излучения на графит, из углеводородов или CCl4 в низкотемпературной плазме. Встречается в природе в виде минерала чаоит (белый углерод), содержится в виде белых вкраплений в графите.
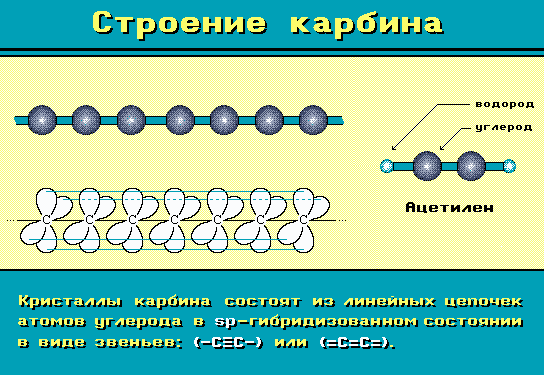
Это вещество впервые получено советскими химиками В.В. Коршаком, А.М. Сладковым, В.И. Касаточкиным и Ю.П. Кудрявцевым в начале 1960-х в Институте элементоорганических соединений Академии наук СССР.
Карбин обладает полупроводниковыми свойствами, причём под воздействием света его проводимость сильно увеличивается. На этом свойстве основано первое практическое применение — в фотоэлементах.








