Энергия активации
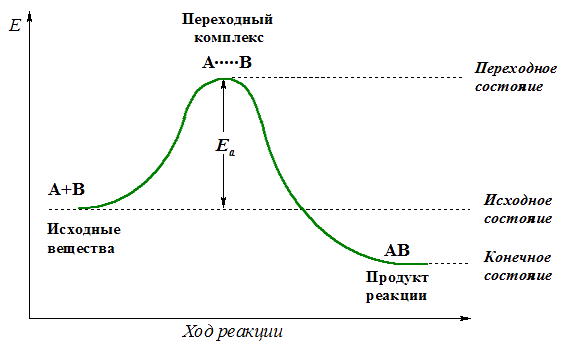
Для эффективного соударения молекул (частиц), приводящего к химической реакции, требуется определенная энергия.Минимальное количество энергии, необходимое для прохождения реакции называют энергией активации.
Эта энергия требуется для достижения системой переходного состояния и образования активированного (переходного) комплекса, который превращается в продукты реакции уже самопроизвольно (примечаниеТермины "переходное состояние" и "переходный комплекс" часто используют как взаимозаменяемые, хотя переходное состояние – это уровень энергии на пути реакции, а переходный комплекс - группировка атомов, находящаяся в переходном состоянии.).
Изменение энергии реагирующей системы можно показать на примере элементарной реакции А + В  АВ:
АВ:
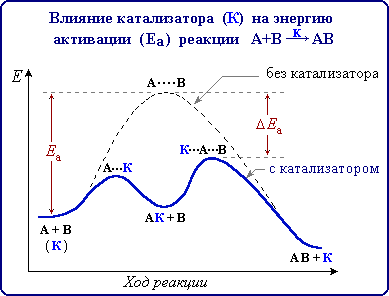 , влияющего на энергию переходного состояния, но не зависит от температуры.
Энергия активации определяет скорость реакции: чем меньше значение Еа, тем выше скорость реакции. Эта зависимость выражается уравнением Аррениуса
, влияющего на энергию переходного состояния, но не зависит от температуры.
Энергия активации определяет скорость реакции: чем меньше значение Еа, тем выше скорость реакции. Эта зависимость выражается уравнением Аррениуса , которое связывает константу скорости реакции Константа скорости реакции (k) – коэффициент пропорциональности, численно равный скорости реакции, когда произведение молярных концентраций реагентов равно 1. Константа скорости реакции зависит от температуры, от природы реагирующих веществ, но не зависит от их концентрации. с энергией активации и температурой. Уравнение Аррениуса более точно, чем правило Вант-ГоффаПравило Вант-Гоффа: "При повышении температуры на 10°С скорость реакции увеличивается в 2-4 раза".
, которое связывает константу скорости реакции Константа скорости реакции (k) – коэффициент пропорциональности, численно равный скорости реакции, когда произведение молярных концентраций реагентов равно 1. Константа скорости реакции зависит от температуры, от природы реагирующих веществ, но не зависит от их концентрации. с энергией активации и температурой. Уравнение Аррениуса более точно, чем правило Вант-ГоффаПравило Вант-Гоффа: "При повышении температуры на 10°С скорость реакции увеличивается в 2-4 раза". Это правило является приближенным и применимо лишь для ориентировочной оценки влияния температуры на скорость реакций, протекающих при температурах, близких к комнатной (энергия активации таких реакций 50-150 кДж/моль). отражает зависимость скорости (константы скорости) реакции от температуры.
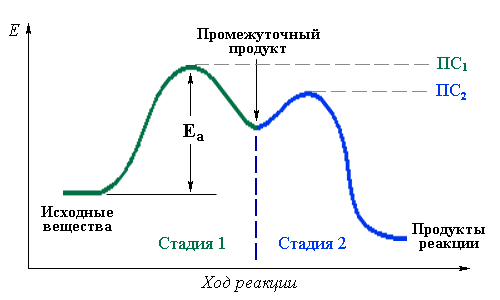
Лимитирующая стадия – элементарная стадия сложной реакции, которая имеет наиболее высокую энергию активации и протекает намного медленнее остальных, ограничивая общую скорость процесса.
Для примера рассмотрим изменение энергии в ходе двухстадийной реакции: