Свойства электрона
Электрон имеет двойственную природу. Находясь в непрерывном движении в поле ядра атома, он проявляет одновременно свойства частицыЭлектрон как частица имеет массу, заряд, собственный момент импульса. (корпускулы) и
волны.Волновые свойства проявляются в дифракции и интерференции электронов.
Связь между волновыми и корпускулярными свойствами электрона отражает соотношение де Бройля:
- где λ – длина волны электрона; m – его масса; v – скорость;
h = 6.62 • 10-34 Дж • с – постоянная Планка.
Волновые свойства электронов служат физической основой электронографических методов исследования атомной структуры различных объектов в молекулярной биологии, физико-химии природных и синтетических полимеров, полупроводников и других материалов. С помощью электронных микроскопов, использующих дифракцию потока ускоренных электронов, можно получать изображения объектов с максимальным увеличением до 106 раз и выше.
Поведение электрона подчиняется законам квантовой механики, фундаментом которой является принцип неопределённости, основанный на корпускулярно-волновой природе микрочастиц.
- * Квантовая механика
- Некоторые физические величины в квантовой механике имеют вероятностный характер. Например, положение (координаты) и скорость микрочастицы невозможно определить точно, а можно лишь рассчитать вероятность их различных значений.
- Изменение некоторых физических величин в квантовой механике происходит не непрерывно, а дискретно. Например, энергия микрочастицы может иметь лишь некоторые определенные значения.
Квантовая механика — физическая теория, устанавливающая законы движения микрочастиц (электронов, протонов и др.). Основные отличия квантовой механики от классической, описывающей движение макрочастиц, заключаются в следующем:
* Принцип неопределённости
Принцип неопределённости Гейзенберга.
Экспериментальные исследования свойств микрочастиц (атомов, электронов, ядер, фотонов и др.) показали, что точность определения их динамических переменных (координат, кинетической энергии, импульсов и т.п.) ограничена и регулируется открытым в 1927 г. В.Гейзенбергом принципом неопределённости. Согласно этому принципу динамические переменные, характеризующие систему, могут быть разделены на две, взаимодополняющие, группы:
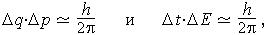
- 1) временны́е и пространственные координаты (t и q);
2) импульсы и энергия (p и E).
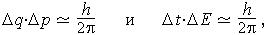
- где Δq, Δp, ΔE, Δt – неопределенности (погрешности) измерения координаты (q), импульса (p), энергии (E) и времени (t); h – постоянная Планка.
Обычно достаточно точно указывают значение энергии микрочастицы, так как эта величина сравнительно легко определяется экспериментально.
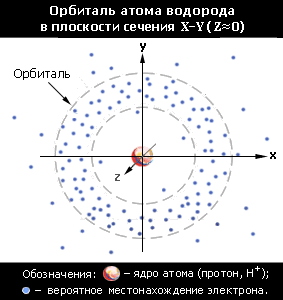
- Часть околоядерного пространства, в котором вероятность нахождения электрона максимальна (не менее 90%), называется электронной орбиталью. Понятие "орбиталь", в отличие от термина "орбита", отражает не траекторию движения электрона, а облако вероятности его присутствия.
Электронная орбиталь в атоме является атомной орбиталью (АО), в молекуле — молекулярной орбиталью (МО).
Примечание. В данном видео, к сожалению, не отражены волновые свойства электрона. Поэтому фраза "Как он (электрон) попадает из одной точки в другую, до сих пор остаётся загадкой." (timeline 3:32-3:37) вводит в заблуждение.
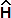 Ψ,
Ψ,где Е – полная энергия системы,
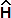 – оператор Гамильтона.
– оператор Гамильтона.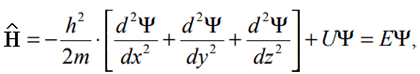
U – потенциальная энергия частицы,
E – полная энергия системы,
x, y, z – координаты частицы.
Уравнение Шрёдингера (1926 г.) — фундаментальное уравнение квантовой механики, объединяющее описание движения электрона как частицы с его описанием в виде волны де Бройля. Принятое как постулат, это уравнение подтверждено экспериментальными исследованиями в атомной и ядерной физике. Уравнение Шрёдингера легло в основу квантовой химии, методы которой позволяют получать количественную информацию об электронном строении, свойствах и реакционной способности химических соединений.
В математическом представлении Ψ-функция является амплитудой стоячей волны,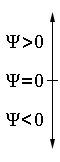
• — узел волновой функции. то есть может иметь положительный или отрицательный знак, а также содержать узлы (при Ψ = 0), где знак функции меняется на противоположный.
Физический смысл имеет не сама Ψ-функция, а квадрат её модуля |Ψ|2dV, который определяет вероятность нахождения электрона в элементарном объеме пространства dV с координатами x, y, z.
- Величину |Ψ|2 называют плотностью вероятности или электронной плотностью.
- Область пространства с максимальным значением |Ψ|2dV (не менее 90% вероятности) принято считать электронной орбиталью.
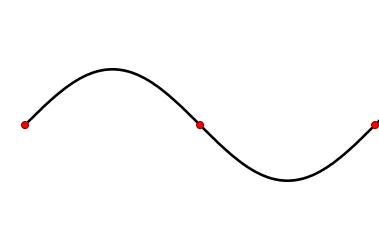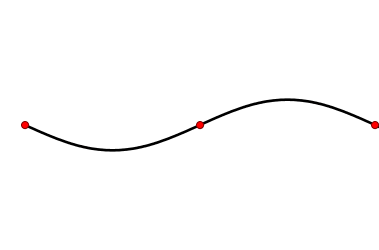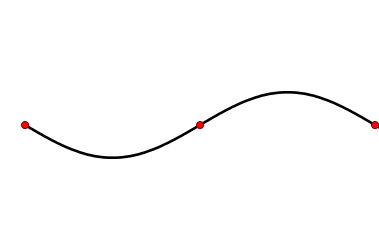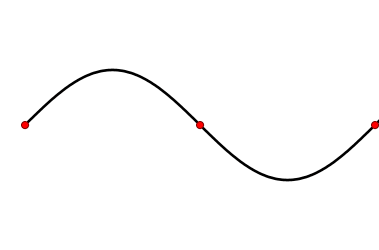
- В случае |Ψ|2 = 0 (при Ψ = 0) орбиталь имеет узловую поверхность, где вероятность присутствия электрона
равна 0 (пример).Схематическое изображение электронной орбитали c одним узлом
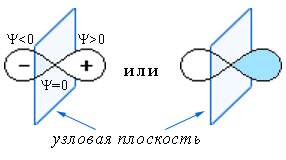
Знаки "+" и "–" относятся к Ψ-функции
(не путать с зарядами).Внешняя поверхность орбитали не является узловой, так как электрон может находиться за пределами её условной (вероятной) границы. Следовательно, на поверхности орбиталиНаличие узловой поверности повышает энергию орбитали. Наиболее низкой энергией обладает не имеющая узлов орбиталь атома водорода (см. выше). Как низшая по энергии, эта орбиталь (обозн. 1s) входит в электронную конфигурацию любых атомов.|Ψ|2 ≠ 0. - Вследствие волнового движения заряд электрона (–1) распределён ("размазан") по всему объёму атомной орбитали.








