Влияние водородных связей на свойства веществ
Водородные связи влияют на физические (т.кип. и т.пл., летучесть, вязкость, спектральные характеристики) и химические (кислотно-основные) свойства соединений.
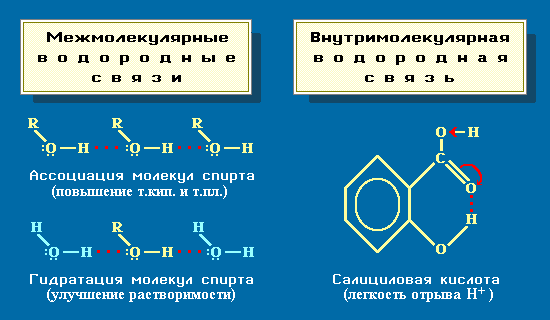
- Различают межмолекулярные и внутримолекулярные водородные связи, которые влияют на свойства вещества различным образом.
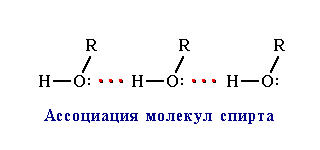 , что приводит к повышению температур кипения и плавления вещества. Например, этиловый спирт C2H5OH, способный к ассоциации, кипит при +78,3°С, а диметиловый эфир СН3ОСН3, не образующий водородных связей, лишь при
, что приводит к повышению температур кипения и плавления вещества. Например, этиловый спирт C2H5OH, способный к ассоциации, кипит при +78,3°С, а диметиловый эфир СН3ОСН3, не образующий водородных связей, лишь при Образование водородных связей с молекулами растворителя способствует улучшению растворимости. Так, метиловый и этиловый спирты (CH3OH, С2Н5ОН), образуя водородные связи с молекулами воды (гидратация спирта
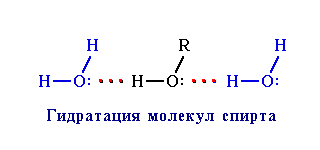 ), неограниченно в ней растворяются. При увеличении размеров углеводородного радикала R в молекулах спирта ROH возникают пространственные затруднения для образования водородных связей. Поэтому с ростом числа атомов углерода в спиртах их растворимость в воде уменьшается.
Внутримолекулярная водородная связь образуется при благоприятном пространственном расположении в молекуле соответствующих групп атомов и специфически влияет на свойства. Например, водородная связь внутри молекул салициловой кислоты повышает ее кислотность.
), неограниченно в ней растворяются. При увеличении размеров углеводородного радикала R в молекулах спирта ROH возникают пространственные затруднения для образования водородных связей. Поэтому с ростом числа атомов углерода в спиртах их растворимость в воде уменьшается.
Внутримолекулярная водородная связь образуется при благоприятном пространственном расположении в молекуле соответствующих групп атомов и специфически влияет на свойства. Например, водородная связь внутри молекул салициловой кислоты повышает ее кислотность.
Водородные связи и их влияние на свойства веществ
Водородные связи играют исключительно важную роль в формировании пространственной структуры биополимеров (белков, полисахаридов, нуклеиновых кислот), что в значительной степени определяет их биологические функции.
Пример: двуспиральная структура ДНК
 обусловлена водородными связями между азотистыми основаниями
обусловлена водородными связями между азотистыми основаниями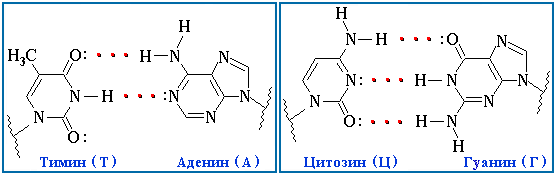 полинуклеотидных цепей.
полинуклеотидных цепей.








