Классификация реакций по механизму разрыва связей
В зависимости от способа разрыва ковалентной связи в реагирующей молекуле органические реакции подразделяются на радикальные и ионные реакции. Ионные реакции в свою очередь делятся по характеру реагента, действующего на молекулу, на электрофильные и нуклеофильные.
Разрыв ковалентной связи может происходить двумя способами, обратными механизмам её образования.- Разрыв связи, при котором каждый атом получает по одному электрону из общей пары, называется гомолитическим:
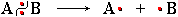
(обратный процесс)
Обменный механизм образования связи - Если при разрыве связи общая электронная пара остается у одного атома, то такой разрыв называется гетеролитическим:
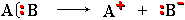
(обратный процесс)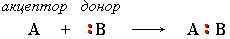
Донорно-акцепторный механизм образования связи
В результате образуются разноименно заряженные ионы – катион и анион.
Если заряд иона сосредоточен на атоме углерода, то катион называют карбокатионом, а анион – карбанионом.
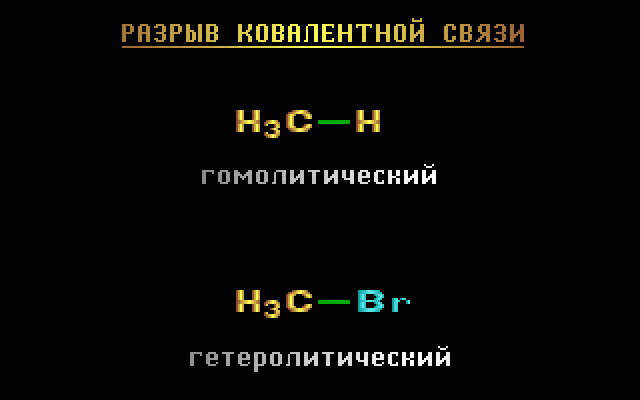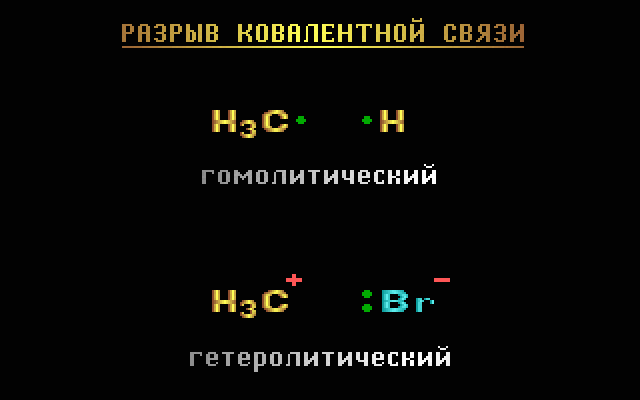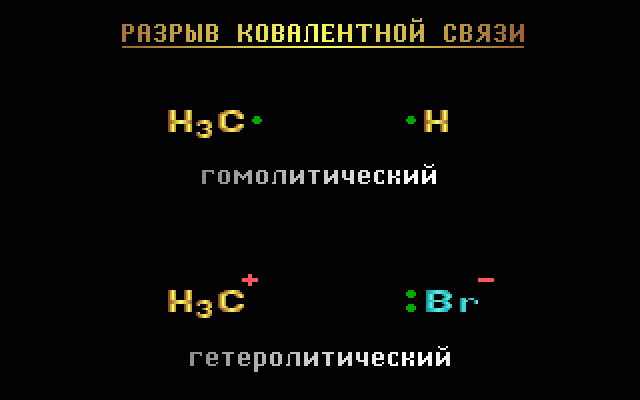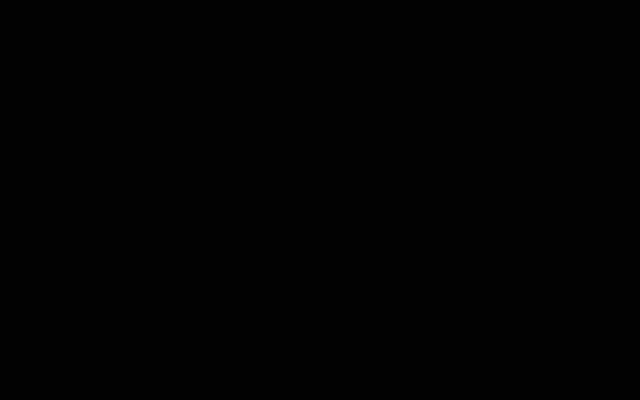
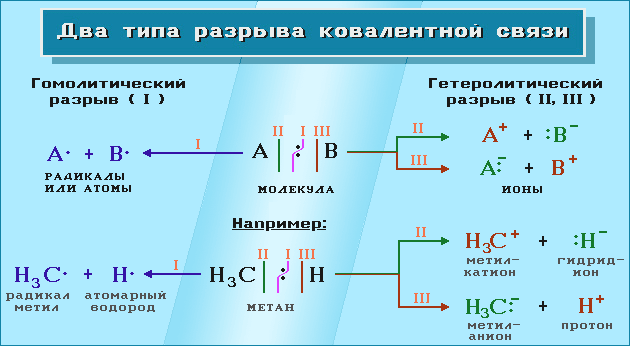
Гомолитический разрыв характерен для неполярных и слабополярных связей, а гетеролитический – для полярных и легко поляризуемых.









