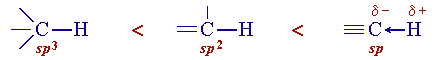Сравнение характеристик атомных орбиталей
От типа гибридизации атомных орбиталей при образовании связи зависят такие важные характеристики, как валентные углы, энергия АО, эффективность σ-перекрывания и электроотрицательность атомов.
- Тип гибридизации атома в молекуле определяется числом связанных с ним атомов и числом его неподеленных электронных пар.

- Валентный угол, образуемый атомом в молекуле, определяется типом гибридизации АО и их пространственной ориентацией:
sp3 (109°28'); sp2 (120°); sp (180°). 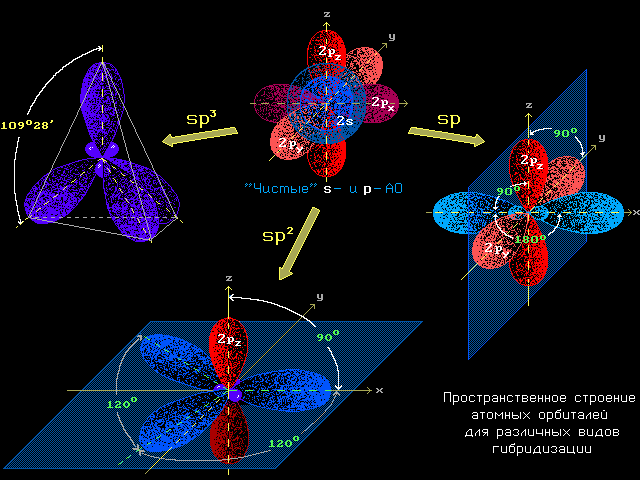
Интерактивная анимация (используйте кнопки-переключатели) - Энергия орбитали возрастает по мере удаления электрона от ядра атома (т.е. с увеличением номера электронного уровня). Кроме того, в пределах одного уровня s-электроны находятся ближе к ядру, чем р-электроны. Поэтому для разного типа гибридных АО энергия уменьшается с увеличением вклада s-АО в гибридизованное состояние:
sp3 (25% s-АО) > sp2 (33,3% s-АО) > sp (50% s-АО) Сравнение энергии негибридных и гибридных АО на примере элементов 2-го периода приводит к следующему ряду:1s < < 2s < 2sp < 2sp2 < 2sp3 < 2px = 2py = 2pz Электронная конфигурация атома в различных состояниях и качественное соотношение энергий 1s, 2s, 2p и гибридизованных орбиталей показана на примере углерода: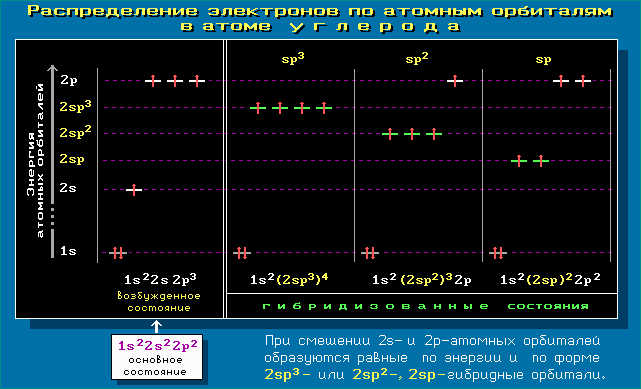
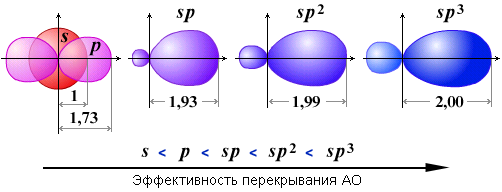
- Эффективность σ-перекрывания АО и, следовательно, прочность σ-связи зависит от размеров электронного облака в направлении линии связи. Если принять радиус s-АО за 1, то по расчетам получают следующий ряд изменения относительных размеров АО и их способности к перекрыванию:
- Электроотрицательность атома возрастает с увеличением доли s-АО в гибридной орбитали. Например, для углерода она изменяется в ряду: