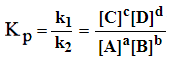Химическое равновесие
Состояние равновесия характерно для обратимых химических реакций.
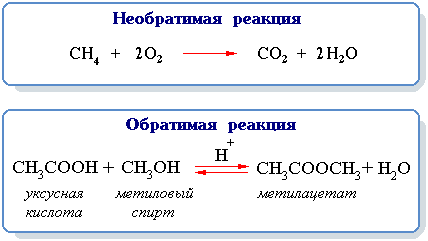
Обратимая реакция – химическая реакция, которая при одних и тех же условиях может идти в прямом и в обратном направлениях.
Необратимой называется реакция, которая идет практически до конца в одном направлении.
Химическое равновесие – состояние системы, в котором скорость прямой реакции равна скорости обратной реакции.
Концентрации всех веществ в состоянии равновесия (равновесные концентрации) постоянны. Химическое равновесие имеет динамический
характер. Это значит, что и прямая и обратная реакции при равновесии не прекращаются.
Для одностадийной обратимой реакции aA + bB
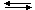 cC + dD
при равновесии выражения для скоростей прямой V1 и обратной реакций V2 имеют вид:
cC + dD
при равновесии выражения для скоростей прямой V1 и обратной реакций V2 имеют вид:
где [A], [B], [C] и [D] – равновесные молярные концентрации веществ A, B, C и D;
a,b,c и d – соответствующие стехиометрические коэффициенты (при условии, что реакция идет в одну стадию);
k1 и k2 – коэффициенты пропорциональности, называемые константами скоростей. Константа скорости реакции (k) - коэффициент пропорциональности в кинетическом уравнении, численно равный скорости реакции, когда концентрации каждого из реагирующих веществ составляют 1 моль/л или их произведение равно единице. Константа скорости реакции зависит от температуры, от природы реагирующих веществ, но не зависит от их концентрации.
Из условия равновесия V1=V2 следует:
a,b,c и d – соответствующие стехиометрические коэффициенты (при условии, что реакция идет в одну стадию);
k1 и k2 – коэффициенты пропорциональности, называемые константами скоростей. Константа скорости реакции (k) - коэффициент пропорциональности в кинетическом уравнении, численно равный скорости реакции, когда концентрации каждого из реагирующих веществ составляют 1 моль/л или их произведение равно единице. Константа скорости реакции зависит от температуры, от природы реагирующих веществ, но не зависит от их концентрации.