Индуктивный эффект (I-эффект)
Известно, что полярная ковалентная связь образуется между атомами с различной электроотрицательностью. Наличие в молекуле полярной σ-связи вызывает поляризацию ближайших двух–трех σ-связей и ведет к возникновению частичных зарядов δ+ (дельта плюс) или δ– (дельта минус) на соседних атомах. Направление смещения электронной плотности всех σ-связей обозначается прямыми стрелками (по линии связи) и символами частичных зарядов (δ), индуцируемых заместителем (X или Y):
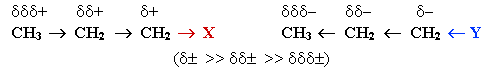
Индуктивный эффект (I-эффект) — смещение электронной плотности по цепи σ-связей, обусловленное различием электроотрицательностей атомов.
Из-за слабой поляризуемости σ-связей I-эффект быстро затухает с удалением от заместителя и через 3-4 связи становится практически равным 0.
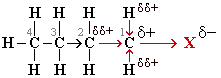
Влияние заместителя на реакционный центр может передаваться не только по цепи σ-связей, но и непосредственно через пространство или через молекулы растворителя по механизму диполь-дипольного взаимодействия.
Индуктивный эффект называют отрицательным (–I), если заместитель уменьшает электронную плотность на атоме углерода, с которым связан этот заместитель. При этом заместитель приобретает частичный отрицательный заряд (δ-), а атом углерода – частичный положительный заряд (δ+).- Передача влияния заместителя через пространство или через растворитель называется эффектом поля (F-эффектом).
Например:
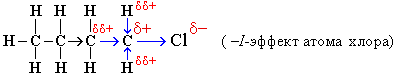
Индуктивный эффект называется положительным (+I), если заместитель увеличивает электронную плотность на атоме углерода, индуцируя на нем частичный отрицательный заряд δ-, сам при этом приобретая заряд δ+.

- –I-эффект проявляют заместители, которые содержат более электроотрицательные атомы, чем атом водорода. К ним относятся многие функциональные группы (галогены, -OH, -OR, -NH2, -NO2, >C=O, -COOH и др.), ненасыщенные группировки (например, -СH=CHR, -C≡CR) и катионы. Такие заместители в целом снижают электронную плотность на остальной части молекулы, то есть являются электроноакцепторами.
- Величина –I-эффекта растёт с увеличением положительного заряда заместителя. Поэтому катионы индуцируют наиболее сильные и дальнодействующие эффекты:
- –I-эффект тем сильнее, чем больше электроотрицательность соответствующего гетероатома:
–NR2 < –OR < –F; –F > –Cl > –Br > –I;
–CR=NR < –CR=O. - Непредельные заместители вызывают –I-эффект, который увеличивается с ростом степени их ненасыщенности:
–CR=CR2 < –CR=CR–CH=CH2 < –C6H5 < –C≡CR;
–CR=NR < –C≡N. - Величина +I-эффекта растет с увеличением отрицательного заряда заместителя. Поэтому анионы проявляют наиболее сильные и дальнодействующие эффекты:
- +I-эффект заместителя тем сильнее, чем меньше электроотрицательность соответствующего гетероэлемента:
- Алкильные группы проявляют относительно слабый +I-эффект, обусловленный суммарным действием слабополярных связей
С–Н (Сδ–←Нδ+). C увеличением числаС–Н-связей +I-эффект возрастает в ряду:-СН3 < -CH2-CH3 < -CH(CH3)2 < -C(CH3)3 В +I-эффекте трет-бутильной группы -C(CH3)3 суммируются полярности 9 связейС–Н.
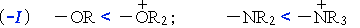
+I-эффект характерен для заместителей, содержащих атомы с относительно низкой электроотрицательностью: металлов (например, -Mg-, -Li), алкильных радикалов (-CH3, -C2H5 и т.п.) и анионов. Заместители, проявляющие +I-эффект, ведут к повышению электронной плотности в цепи и проявляют электронодонорные свойства.
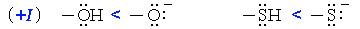
-Na > -MgR > -AlR2 > -SiR3








