Неполярная ковалентная связь
Неполярная (симметричная) ковалентная связь – связь между атомами с равной электроотрицательностью (Δχ = 0) и, следовательно, равномерным распределением электронной плотности между ядрами атомов:
-
H — H, F — F, Cl — Cl, O = O, N ≡ N и т.п.
- Например, связь C—C в молекуле H3C—CH3.
Связи между одинаковыми атомами, имеющими различное окружение, к неполярным не относятся.
-
Например: H3C—CH=O (ацетальдегид), H3C—COOH (уксусная кислота)
(дипольные моменты связей C—C 2,7 D и 1,7 D, соответственно).
- Δχ = 2,5(С) – 2,1(Н) = 0,4 (дипольный момент связи 0,2 D).
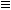 CH, RC
CH, RC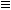 CH и т.п.) электроотрицательность углерода выше и связь
CH и т.п.) электроотрицательность углерода выше и связь 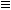 C–H,
C–H,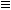 C–H).
C–H).







