Свойства ковалентной связи
Характерные свойства ковалентной связи – направленность, насыщаемость, полярность, поляризуемость – определяют химические и физические свойства органических соединений.
Направленность связи обусловливает молекулярное строение органических веществ и геометрическую форму их молекул. Углы между двумя связями называют валентными.
Насыщаемость – способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей.
Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. По этому признаку ковалентные связи подразделяются на неполярные и полярные.
Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Электроны тем подвижнее, чем дальше они находятся от ядер.
Полярность и поляризуемость ковалентных связей определяют реакционную способность молекул по отношению к полярным реагентам.
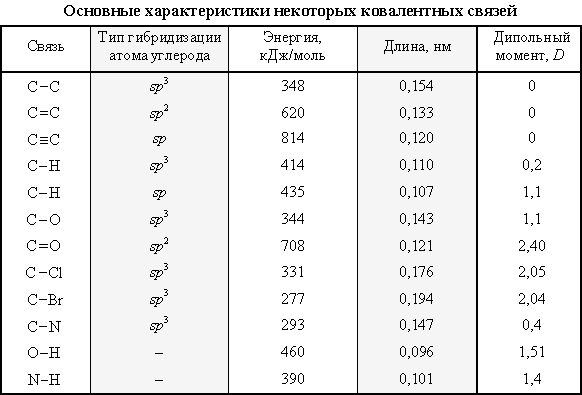
Важными количественными характеристиками ковалентной связи являются энергия связи, ее длина и дипольный момент.
- Энергия связи – энергия, выделяющаяся при ее образовании, или необходимая для разъединения двух связанных атомов (измеряется в кДж/моль). Энергия связи характеризует ее прочность.
- Длина связи – расстояние между центрами связанных атомов. Чем меньше длина, тем прочнее химическая связь. Единица измерения – нанометр (нм): 1 нм = 10−9м. Длину связи выражают также в ангстремах (Å):
1 Å = 10−10м = 0,1 нм. - Дипольный момент связи (μ) – векторная величина,
характеризующая полярность связи; измеряется в
дебаях (D) или кулон-метрах: 1D = 3,4⋅10-30 Кл⋅м.
На характеристики связей влияет их кратность:
- энергия связи увеличивается в ряду: C–C < C=C < C≡C;
- длина связи растет в обратном порядке: C≡C < C=C < C–C.