Водородные связи (Н-связи)
Важную роль в химии органических соединений играют водородные связи, влияющие на физические (температуры кипения и плавления, летучесть, вязкость, плотность, спектральные характеристики), химические (кислотно-основные) и другие свойства соединений.
Атом водорода, связанный с сильно электроотрицательным элементом (азотом, кислородом, фтором и др.), испытывает недостаток электронов и поэтому способен взаимодействовать с неподеленной парой электронов другого электроотрицательного атома этой же или другой молекулы. В результате возникает
водородная связь (Н-связь), которая графически обозначается тремя точками:

В настоящее время в рамках теории молекулярных орбиталей водородная связь рассматривается как частный случай ковалентной трехцентровой делокализованой связи.
Эта связь значительно слабее других химических связей (энергия ее образования 10-40 кДж/моль) и в основном определяется электростатическим и донорно-акцепторным взаимодействиями.
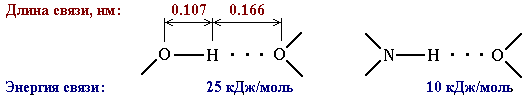
Энергия водородной связи возрастает с увеличением электроотрицательности и уменьшением размеров атомов, с которыми проходит связывание.
Поэтому наиболее прочные водородные связи возникают, когда в качестве таких атомов выступают F, О или N. Несмотря на высокую электроотрицательность хлора, водородная связь –Н···Cl– относительно слабая из-за большого размера атома хлора.
Почему связи типа водородных не образуют атомы других элементов?
Это объясняется тем, силы электростатического притяжения разноименных концов диполей полярных связей (О-Н, N-H и т.п.) довольно слабы и действуют лишь на малых расстояниях. Водород, обладая наименьшим атомным радиусом, позволяет сблизиться таким диполям настолько, что силы притяжения становятся заметными. Никакой другой элемент с большим атомным радиусом не способен к образованию подобных связей.










