Кратные связи
Встречающиеся в органических соединениях кратные связи (двойные или тройные):
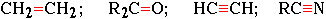 ,
,Кратные связи являются сочетанием σ- и π-связей.
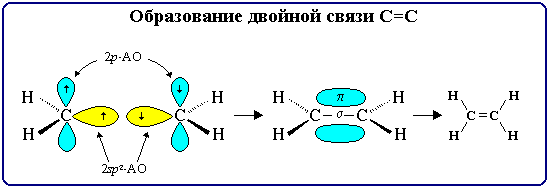
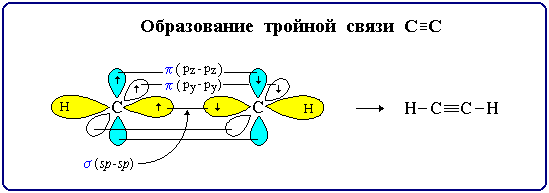
Число электронных пар, участвующих в образовании ковалентной связи называется порядком связи.
В случае сопряжённых (делокализованных) связей порядок связи отличается от этих целочисленных значений
Делокализованная связь — связь, электронная пара которой рассредоточена между несколькими (более двух) ядрами атомов (подобие металлической связи).
Такая делокализация (рассредоточение) электронов характерна для сопряжённых π-связей, то есть кратных связей, чередующихся с одинарными. Делокализация подвижных π-электронов приводит к тому, что в сопряжённой системе связи становятся нецелочисленными (дробными), то есть ни двойными или тройными, ни одинарными.
Например, делокализация π-связей в молекуле CH2=CH–CH=CH2 обусловлена возможностью перекрывания р-орбиталей атомов C2 и C3:

Порядок связиПорядок связи — это число электронных пар, участвующих в ее образовании. Порядок связи С–С равен 1, порядок локализованной связи С=С соответствует 2. C1–C2 или C3–C4 равен 1,894, а связи C2–C3 – 1,447
(данные расчёта по методу Хюккеля).








