Образование водородных связей (на примере спиртов)
В молекуле спирта R-O-H химическая связь между атомом водорода и более электроотрицательным атомом кислорода весьма полярна. Водород имеет частичный положительный заряд (δ+), а кислород – частичный отрицательный (δ-):
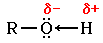
R - углеводородный радикал (CH3, C2H5 и т.п.)
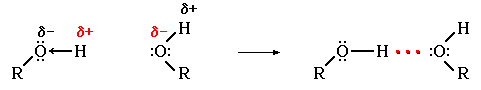
В присутствии воды возникают водородные связи между молекулами спирта и воды:
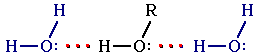
Поэтому низшие спирты хорошо растворимы в воде.








