Группа –COOHСтруктурная формула
карбоксильной группы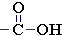 содержит две функциональные группы — карбонильную >С=О и гидроксильную –OH, связанные между собой. Строение и свойства этих групп рассматривались ранее: ОН-группа в разделе "Спирты и фенолы", группа >С=О в разделе "Альдегиды и кетоны". Находясь в непосредственной связи, эти группы взаимно влияют друг на друга и видоизменяют свои свойства.
содержит две функциональные группы — карбонильную >С=О и гидроксильную –OH, связанные между собой. Строение и свойства этих групп рассматривались ранее: ОН-группа в разделе "Спирты и фенолы", группа >С=О в разделе "Альдегиды и кетоны". Находясь в непосредственной связи, эти группы взаимно влияют друг на друга и видоизменяют свои свойства.
Для атомов углерода и кислорода группы >C=O характерно состояние sp2-гибридизации.
Атом кислорода
| Группа | Электронный эффект |
| >С=О | –I и –M |
| –ОН | +M и более слабый –I |
| –СООН | –I и –M* |
* Для группы СООН при sp2 или sp-атоме радикала R.
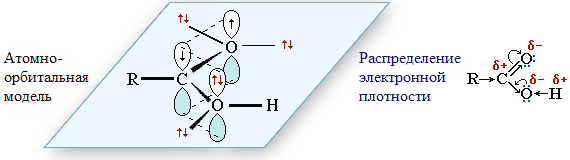
Электронное строение карбоксильной группы придаёт карбоновым кислотам характерные свойства.
- Карбоксильная группа содержит три полярные ковалентные связи: С=О, С–О и О–Н, способные к гетеролитическому разрыву. Поэтому реакции с их участием идут в основном по ионному механизму.
- Смещение электронной плотности к карбонильному атому кислорода вызывает дополнительную, по сравнению со спиртами и фенолами, поляризацию связи О–Н, что определяет бо́льшую подвижность водородного атома, то есть более сильные кислотные свойства.
- Пониженная электронная плотность (δ+) на атоме углерода в СООН-группе способствует взаимодействию карбоновых кислот с нуклеофильными реагентамиНуклеофильные реагенты, или нуклеофилы — это частицы (анионы или молекулы), имеющие неподеленную пару электронов на внешнем электронном уровне и способные передать эти электроны на образование связи по донорно-акцепторному механизму.. При этом +М-эффект ОН-группы уменьшает частичный положительный заряд атома углерода в группе С=О. В отличие от альдегидов и кетонов, вступающих с нуклеофилами в реакцию нуклеофильного присоединения, для карбоновых кислот характерно нуклеофильное замещение группы –ОН.
- Атом кислорода в группе С=О, имея неподелённую пару электронов, способен присоединять протон Н+ (при действии сильной кислоты). Это играет важную роль в кислотном катализе реакций нуклеофильного замещения.
- Группа –СООН за счёт положительного заряда на атоме углерода снижает электронную плотность на связанном с ней углеводородном радикале R, то есть является по отношению к нему электроноакцепторным заместителем. В случае предельных кислот карбоксильная группа проявляет –I-эффект, а в непредельных (например,
CH2=CH–COOH) и ароматических(С6Н5–СООН) — как –I, так и –М-эффект. Выступая в качестве заместителя, карбоксильная группа влияет на направление реакций, идущих по углеводородному радикалу. - Атом водорода в полярной группе Оδ––Нδ+ одной молекулы кислоты и атом кислорода группы Сδ+=Оδ– другой молекулы способны к образованию межмолекулярной водородной связи
–O–H...O=C, что во многом определяет физические свойства карбоновых кислот.








