- - замещения атома водорода в α-СН-группе алкильного радикала;
- замещения водорода в бензольном кольце ароматического радикала;
- присоединения по кратной углерод-углеродной связи непредельного радикала.
Замещение водорода в α-СН-звене радикала
Реакции этого типа характерны для предельных карбоновых кислот, в молекулах которых группа -СOОH находится при sp3-атоме углерода алкильного радикала (метильного -CH3, первичного -CH2R или вторичного -CHR2). Под влиянием –I-эффекта карбоксильной группы в молекуле карбоновой кислоты повышается полярность связи С–Н в α-положении (соседнем с группой СООН). Это увеличивает подвижность атома водорода и способствует его замещению.
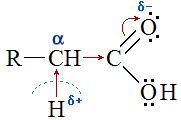
 CH3CHClCOOH + HCl
CH3CHClCOOH + HCl
Реакция галогенирования насыщенных карбоновых кислот имеет важное значение, так как открывает путь к синтезу гетерофункциональных кислот – α-гидрокси- и α-аминокислот.
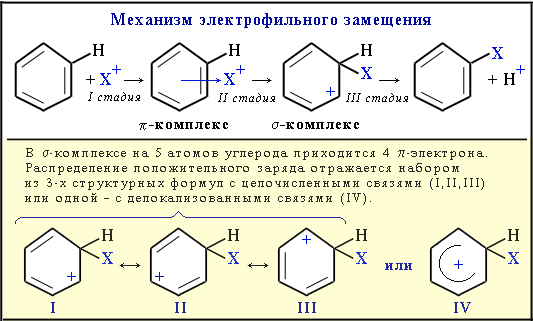
Замещение в ароматическом радикале
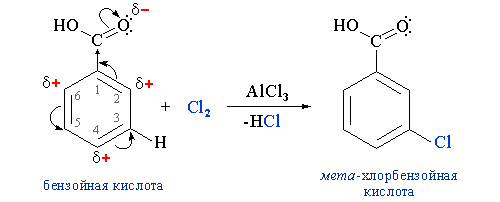
Ароматические карбоновые кислоты вступают в реакции электрофильного замещения по бензольному кольцу в соответствии с правилами ориентации. По отношению к ароматическому радикалу карбоксильная группа является электроноакцепторным заместителем (–I, –М-эффекты) и относится к ориентантам 2-го рода. Понижая электронную плотность в бензольном кольце, особенно в орто- и пара-положениях (2,6 и 4), эта группа направляет электрофильное замещение в ароматическом ядре в мета-положение (3 или 5). Например:
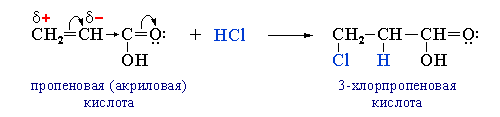
Присоединение по связи С=С в непредельном радикале
Непредельные карбоновые кислоты способны к реакциям присоединения по кратным углерод-углеродным связям в углеводородном радикале. Наибольшее влияние на эти реакции оказывает группа –CОOН, если она находится в сопряжении со связью С=С (например, в акриловой кислоте CH2=CH–CООH) и проявляет по отношению к радикалу –I и –М-эффекты. В этом случае карбоновая кислота вступает в реакцию электрофильного присоединения против правила Марковникова: