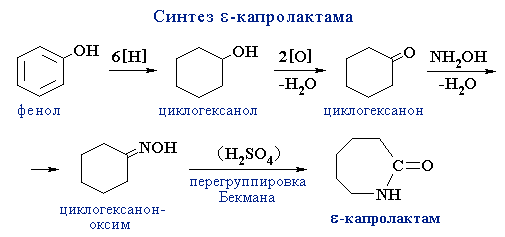
Окисление спиртов и фенолов
Для окисления гидроксисоединений используются соединения марганца(IV), марганца(VII), хрома(VI), оксиды металлов (Cu, Zn, Ag) и др.
Легкость окисления одноатомных спиртов уменьшается в ряду:
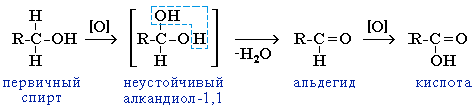
Окисления альдегида в карбоновую кислоту можно избежать, удаляя его из реакционной смеси путем отгонки
(альдегид кипит при более низкой температуре, так как его молекулы не ассоциированы за счет водородных связей).
 Видеоопыт "Окисление этилового спирта оксидом меди (II)".
Видеоопыт "Окисление этилового спирта оксидом меди (II)". Видеоопыт "Окисление этанола раствором перманганата калия".
Видеоопыт "Окисление этанола раствором перманганата калия". Видеоопыт "Окисление этанола (тест на алкоголь)".
Видеоопыт "Окисление этанола (тест на алкоголь)".
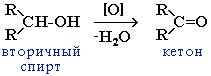
Промышленное значение имеет реакция окисления вторичного алициклического спирта циклогексанола до кетона циклогексанона:

Окисление первичных и вторичных спиртов происходит также в результате реакции дегидрирования (отщепления водорода) при пропускании паров спирта над нагретым катализатором (Cu, соединения Ag, Cr, или Zn). В этих условиях процесс идёт как внутримолекулярная окислительно-восстановительная реакция.


Данный метод позволяет превращать первичные спирты в альдегиды без их дальнейшего окисления до кислот.
Третичные спирты более устойчивы к действию окислителей. Если первичные и вторичные спирты окисляются в кислой, нейтральной и щелочной средах, то третичные спирты реагируют лишь в жестких условиях – кислая среда, повышенная температура. Это приводит к разрушению углеродного скелета молекулы и образованию смеси продуктов – карбоновых кислот и кетонов с меньшим числом углеродных атомов.
- Процесс идет через стадию дегидратации спирта с последующим деструктивным (жестким) окислением алкена. Например:

- Устойчивость третичных спиртов при окислении позволяет отличить их от первичных и вторичных спиртов по реакции с разбавленным щелочным раствором перманганата калия.
Соединения с ОН-группами у соседних атомов углерода (1,2-диолы, 1,2,3-триолы и т.п.) окисляются наиболее легко. В зависимости от условий их окисление происходит с сохранением
Пример 1. Окисление этиленгликоля при действии CrO3 или HNO3

Пример 2. Окисление раствором перманганата калия в кислой среде при нагревании
Деструктивное окисление многоатомных спиртов с соседними ОН-группами
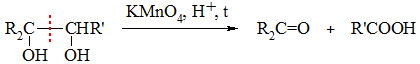
Кетон R2C=O образуется из фрагмента, содержащего третичную спиртовую группу, а карбоновая кислота R'COOH – из фрагмента с вторичной группой ОН.
При наличии фрагмента с первично-спиртовой группой –CH2OH образуется CO2:

Пример 3. Взаимодействие глицерина с кристаллическим перманганатом калия (видео)
Взаимодействие глицерина с кристаллическим перманганатом калия
2С3Н8О3 + 7О2 → 6СО2 + 8Н2О + Q

Пример 2. Окисление раствором перманганата калия в кислой среде при нагревании
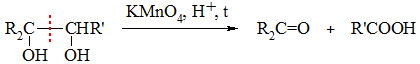

Пример 3. Взаимодействие глицерина с кристаллическим перманганатом калия (видео)
| Источник:
Постановка опыта – к.п.н. Павел Беспалов. |
Характерной реакцией многоатомных спиртов с соседними ОН-группами является окисление водным раствором иодной кислоты HIO4, которая не окисляет одноатомные спирты и многоатомные спирты других типов. Подробнее...
Взаимодействие иодной кислоты и многоатомных спиртов с соседними ОН-группами
Реакция протекает через стадию образования циклического сложного эфира иодной кислоты (иодата), который расщепляется далее по связи С–С с выделением иодноватой кислоты:

Кроме иодной кислоты для гликольного расщепления применяют также тетраацетат свинца (CH3COO)4Pb в органическом растворителе.


Кроме иодной кислоты для гликольного расщепления применяют также тетраацетат свинца (CH3COO)4Pb в органическом растворителе.
Фенолы окисляются легче спиртов. Эти реакции протекают многоступенчато с образованием довольно сложной смеси продуктов. Многие из фенолов, являясь бесцветными веществами, при стоянии на воздухе приобретают окраску за счёт примеси продуктов окисления.
Действие на фенол сильных окислителей (CrО3, хромовая смесь) приводит к образованию пара-бензохинона (наряду с другими продуктами окисления). Реакция идёт с отщеплением наиболее подвижного атома водорода в пара-положении бензольного кольца.


 , количественно поглощающего кислород.
, количественно поглощающего кислород.
Предельное окисление гидроксисоединений до CO2 и Н2О происходит при их горении, например:

 , количественно поглощающего кислород.
, количественно поглощающего кислород.
 2CO2 + 4H2O
2CO2 + 4H2O
При сгорании спиртов выделяется большое количество тепла.
 2CO2 + 3H2O + 1370 кДж
2CO2 + 3H2O + 1370 кДж Видеоопыт "Взаимодействие глицерина с кристаллическим перманганатом калия".
Видеоопыт "Взаимодействие глицерина с кристаллическим перманганатом калия".