Химические связи кислорода
Строение и, следовательно, свойства соединений кислорода определяются характером его химических связей и типом гибридизации, влияющей на форму молекулы.
|
Тип гибридизации кислорода |
Электронная конфигурация |
Число гибридных орбиталей |
Валентный угол |
|
sp3 |
1s2(2sp3 )6
|
4 |
108,5° |
|
sp2 |
1s2(2sp2 )52p1
|
3 |
120° |
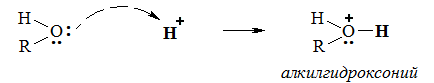
Такое взаимодействие кислородсодержащих соединений играет важную роль при проведении реакций в присутствии сильных минеральных кислот в качестве катализаторов (кислотный катализ).
Положительно заряженный атом кислорода может участвовать в образовании ионной связи с анионами. Например, в хлориде метилгидроксония:
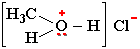
Атом кислорода с тремя неподеленными электронными парами имеет отрицательный заряд и способен к образованию ионной связи с катионами металлов: RO–Na+, RCOO–K+.
Таким образом, в химических связях кислорода с другими атомами возможно различное распределение электронных пар и возникновение заряженных частиц.
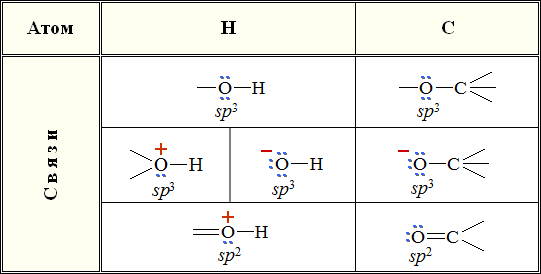
Электроотрицательности кислорода, водорода, углерода, соответственно, равны 3.5, 2.1 и 2.5. Поэтому связи O–H и C–O являются ковалентными полярными. В этих связях электронная плотность смещена к более электроотрицательному атому кислорода, создавая на нем частичный отрицательный заряд, а на углероде или водороде – частичный положительный.
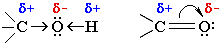
Распределение электронной плотности на атомах молекулы определяет реакционную способность вещества.
- Полярность связей кислорода с водородом и углеродом способствует гетеролитическому их разрыву и протеканию реакций по ионному механизму (часть I. Ионные реакции).
- Легкость гетеролитического разрыва связи зависит не только от ее полярности, но и от устойчивости ионов, образующихся при этом на промежуточных стадиях реакции. Для более стабильных (легче образуемых) ионов характерна наибольшая делокализация заряда (часть I. Роль промежуточных частиц).
- Молекулы, содержащие связи О–Н, образуют водородные связи, которые влияют на физические свойства вещества (часть I, Водородные связи).








