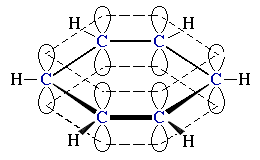
sp2-Гибридизация (плоскостно-тригональная)
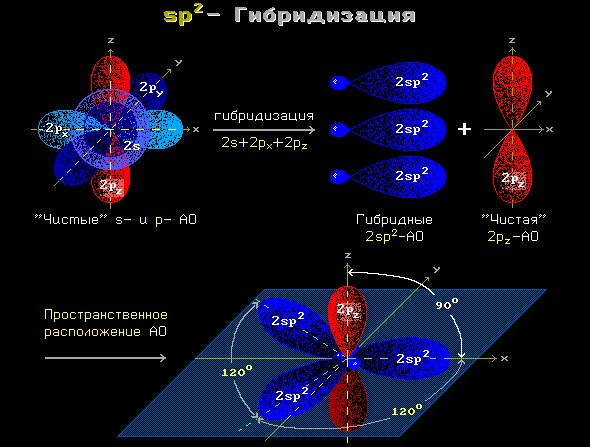
Одна s- и две p-орбитали смешиваются, и образуются три равноценные sp2-гибридные орбитали, расположенные в одной плоскости под углом 120° (выделены синим цветом). Они могут образовывать три σ-связи. Третья р-орбиталь остается негибридизованной и ориентируется перпендикулярно плоскости расположения гибридных орбиталей. Эта р-АО участвует в образовании π-связи.

VRML-модель (2 камеры, 109,3 Кб).
Для элементов 2-го периода процесс sp2-гибридизации происходит по схеме:
2pz-АО в гибридизации не участвует.

Переход от орбитальной модели sp2-атома (а) к пространственной формуле (б).
Иллюстрация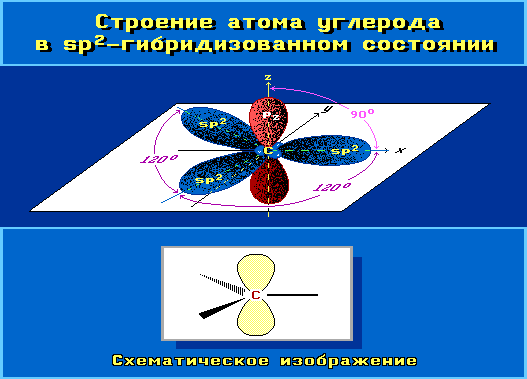
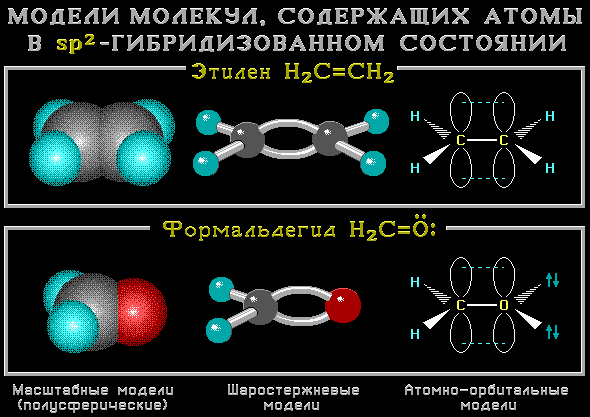
sp2-Гибридизованное состояние свойственно атому, если сумма числа связанных с ним атомов и числа его неподеленных электронных
пар равна 3 (примеры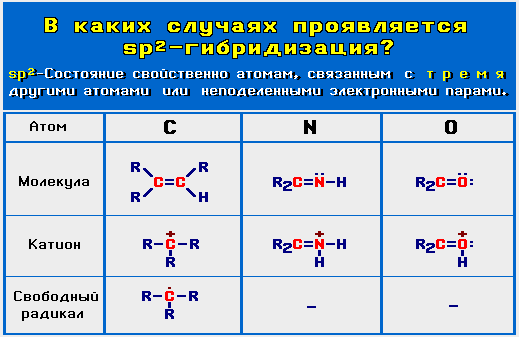 ).
).
 ).
).- Кроме того, sp2-состояние оказывается выгодным и для атомов с неподеленными парами электронов, если такой атом связан с другим sp2- или sp-атомом. При этом значение суммы может быть равно 4.
Например, sp2-атом кислорода в феноле C6H5OH
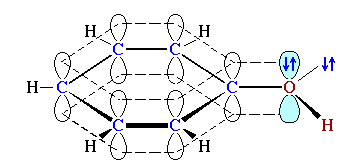 , связанный с sp2-атомом углерода бензольного кольца.
, связанный с sp2-атомом углерода бензольного кольца.

Фуллерен C60, VRML-модель) и другие наноструктуры.
sp2-Гибридизация характерна для атомов С, N, O и др. с двойной связью (sp2-атомы выделены красным цветом):