Заполнение атомных орбиталей электронами
При заполнении атомных орбиталей электронами соблюдаются
три основные правила.
Принцип устойчивости. АО заполняются электронами в порядке повышения их энергии:
1s < 2s < 2p < 3s < 3p < 4s < 3d ...
Заполнение электронами 4s-АО предшествует 3d-АО в соответствии с
правилом Клечковского.Правило Клечковского:
энергия АО повышается с увеличением суммы (n+ℓ). Для подуровня 3d сумма n+ℓ=3+2=5 выше, чем значение суммы для 4s n+ℓ=4+0=4.
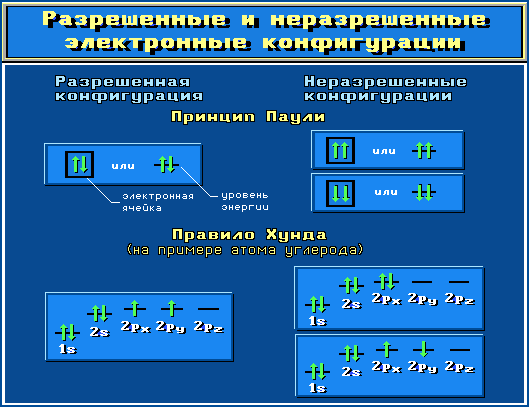
Принцип Паули. На одной АО могут находиться не более двух электронов с противоположными спинами.
Правило Хунда. На АО с одинаковой энергией, так называемых вырожденных орбиталях, электроны располагаются по одному с параллельными спинами.
Электронные конфигурации
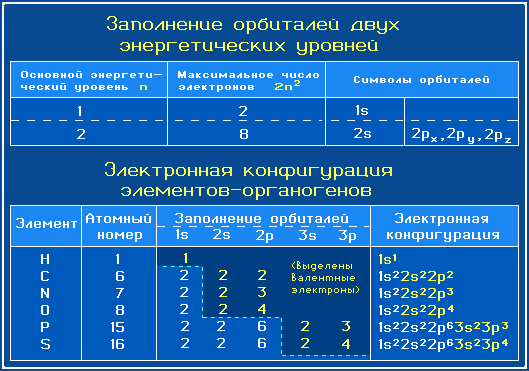
В химических превращениях принимают участие электроны внешнего электронного уровня – валентные электроны.
Наиболее распространенные в органических соединениях элементы (элементы-органогены) относятся в основном ко 2-му (C, N, O) и 3-му (P, S, Cl) периодам Периодической системы. Валентными электронами этих элементов являются 2
s-, 2
р- и 3
s-, 3
р-электроны, соответственно.
Валентные электроны элементов-органогенов










