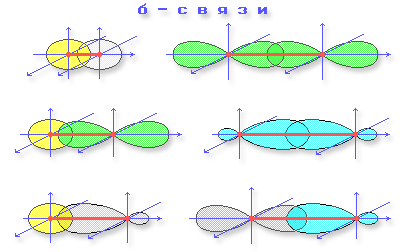
σ-, π-Связи
При образовании ковалентной связи в молекулах органических соединений общая электронная пара заселяет связывающие молекулярные орбитали, имеющие более низкую энергию. В зависимости от формы МО (σ-МО или π-МО) образующиеся связи относят к σ- или π-типу.
- σ-Связь – ковалентная связь, образованная при перекрывании s-, p- и гибридных АО вдоль оси, соединяющей ядра связываемых атомов (т.е. при осевом перекрывании АО).
- π-Связь – ковалентная связь, возникающая при боковом перекрывании негибридных
р-АО. Такое перекрывание происходит вне прямой, соединяющей ядра атомов.
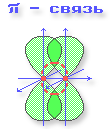
Пример: образование π-связи между атомами углерода
Различное строение σ- и π-молекулярных орбиталей определяет характерные особенности σ- и π-связей.
- σ-Связь прочнее π-связи. Это обусловлено более эффективным осевым перекрыванием АО при образовании σ-МО и нахождением σ-электронов между ядрами.
- Электроны на π-МО, находясь вне межъядерного пространства, обладают большей подвижностью по сравнению с σ-электронами. Поэтому поляризуемость π-связи значительно выше, чем σ-связи.
- По σ-связям возможно внутримолекулярное вращение атомов, т.к. форма σ-МО допускает такое вращение без разрыва связи.
Пример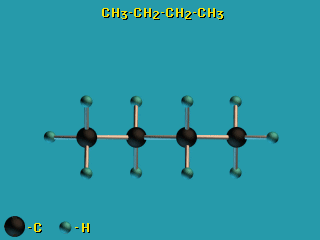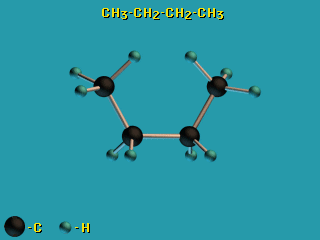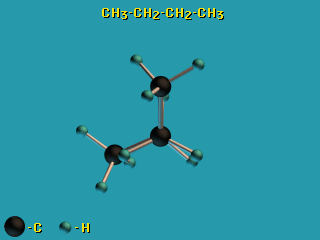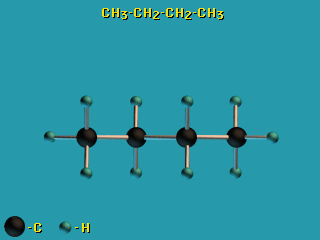 – вращение по σ-связям в молекуле н-бутана H3C–CH2–CH2–CH3.
– вращение по σ-связям в молекуле н-бутана H3C–CH2–CH2–CH3.
Это свойство σ-связей играет важную роль в органической химии, химии природных соединений, физико-химии полимеров. - В связи с отсутствием вращательной симметрии у π-МО (из-за наличия узловой плоскости) поворот по двойной (σ + π) связи невозможен без разрыва π-связи.








