Если у атома, вступающего в химическую связь, имеются неспаренные электроны на разных орбиталях (s-, p-, d- или f-), то в процессе формирования химической связи происходит гибридизация (смешение) орбиталей, т.е. из разнотипных АО образуется набор одинаковых (гибридных). Гибридные орбитали из одного набора эквивалентны: их нельзя отличить друг от друга по форме или по энергии, у них не совпадает только ориентация в пространстве.
Например, комбинация 2s-АО и 2p-АО дает две гибридные 2sp-АО:


Гибридизация АО происходит при образовании ковалентной связи, если при этом достигается более эффективное перекрывание орбиталей. Таким образом, гибридные орбитали свойственны только атомам в молекулах, а не свободным атомам.
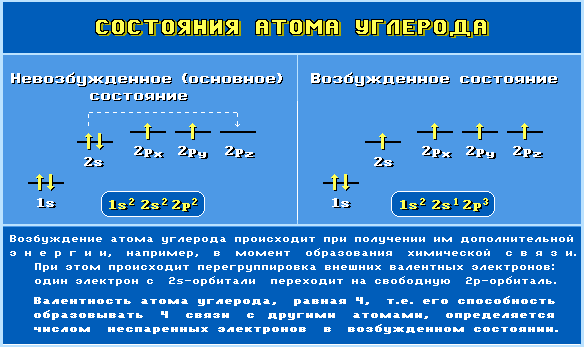
Гибридизация атома углерода сопровождается его возбуждением и переносом электрона с 2s- на 2р-АО:Основное и возбужденное состояния атома углерода.
Cхема

- для атомов углерода и азота – sp3, sp2 и sp;
- для атома кислорода – sp3, sp2;
- для галогенов – sp3, sp2.
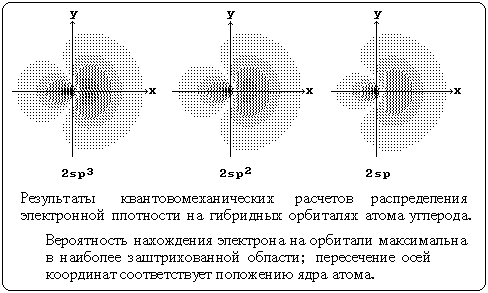
 В отличие от негибридных s- или р-АО она имеет одну большую долю, которая хорошо образует химическую связь, и малую долю, которую обычно даже не изображают, хотя она может играть роль в некоторых реакциях. Гибридизованные АО при взаимодействии с орбиталями различных типов (s-, р- или гибридными АО) других атомов обычно дают σ-МО, т.е. образуют σ-связи. Такая связь прочнее связи, образованной электронами негибридных АО, за счет более эффективного перекрывания.
В отличие от негибридных s- или р-АО она имеет одну большую долю, которая хорошо образует химическую связь, и малую долю, которую обычно даже не изображают, хотя она может играть роль в некоторых реакциях. Гибридизованные АО при взаимодействии с орбиталями различных типов (s-, р- или гибридными АО) других атомов обычно дают σ-МО, т.е. образуют σ-связи. Такая связь прочнее связи, образованной электронами негибридных АО, за счет более эффективного перекрывания.
- Типы гибридизации АО
Тип
гибридизацииЧисло
гибридных
орбиталейГеометрия Структура Примеры sp 2 Линейная 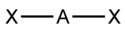
HC≡CH, CO2, NO2+, BeF2,
sp2 3 Тригональная 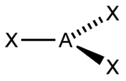
H2C=CH2, C6H6, BF3, NO3-, CO32-
sp3, d3s 4 Тетраэдрическая 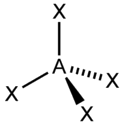
CH4, ClO4-, SO42-, NH4+
dsp2 4 Плоскоквадратная 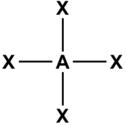
[Ni(CN)4]2- [PdCl4]2- sp3d 5 Гексаэдрическая 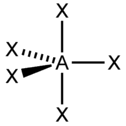
PCl5, AsF5 sp3d2, d2sp3 6 Октаэдрическая 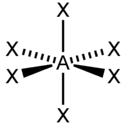
SF6, Fe(CN)63-, CoF63- Сама гибридизация не является реальным физическим процессом, а только удобной моделью, позволяющей объяснить электронное строение молекул, в частности гипотетические видоизменения атомных орбиталей при образовании ковалентной химической связи, в частности, выравнивание длин химических связей и валентных углов в молекуле.
Концепция гибридизации с успехом была применена для качественного описания простых молекул, но позднее была расширена и для более сложных. В отличие от теории молекулярных орбиталей, эта концепция не является строго количественной, например она не в состоянии предсказать фотоэлектронные спектры даже таких простых молекул как вода. В настоящее время модель гибридизации АО используется в основном в методических целях и в синтетической органической химии.








