- где c1 и c2 – молярные концентрации вещества в моменты времени t1 и t2,
соответственно; знак "+" ставится, если скорость определяется по продукту реакции, знак "–" - по исходному веществу.
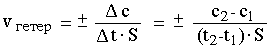
где S – единица площади межфазной поверхности.
- концентрация реагентов (закон действующих масс)
Закон действующих масс — основной постулат химической кинетики, устанавливающий зависимость скорости реакции от концентрации реагирующих веществ.
- Скорость химической реакции пропорциональна произведению концентраций реагирующих веществ.
Так, для реакции aA + bB → продукты реакции (a, b – стехиометрические коэффициенты) закон действующих масс выражается уравнением:
v = k [А]х [B]у, -
где v – скорость реакции; k – коэффициент пропорциональности, или константа скорости реакции;
[А] и [B] – молярные концентрации веществ А и В, соответственно;
х и у – экспериментально определяемые числа, называемые порядком реакции по веществам А и В.
Сумма показателей степенейx+y называется общим порядком реакции.
Если реакция проходит в одну стадию, то порядки по веществам равны стехиометрическим коэффициентам (х = a и у = b), а общий порядок соответствует молекулярности реакции (т.е. минимальному числу частиц, участвующих в элементарной стадии).
Чаще всегох ≠ а иу ≠ b, так как большинство реакций протекает в несколько стадий.Константа скорости реакции (k). Физический смысл этой константы следует из уравнения закона действующих масс: k – коэффициент пропорциональности, численно равный скорости реакции, когда произведение молярных концентраций реагентов равно 1. Константа скорости реакции зависит от температуры, от природы реагирующих веществ, но не зависит от их концентрации.
Следует иметь в виду, что размерность константы скорости зависит от порядка реакции. Для реакций 1-го порядка k выражается в 1/c, 2-го порядка – в л/моль·с, 3-го порядка – вл2/моль2·с и т.д. Поэтому называть константу k скоростью (удельной скоростью) реакции можно лишь для реакций 2-го порядка, когда размерность k соответствует размерности скорости. - температура (правило Вант-ГоффаПравило Вант-Гоффа: "При повышении температуры на 10°С скорость реакции увеличивается в 2-4 раза".
Это правило является приближенным и применимо лишь для ориентировочной оценки влияния температуры на скорость реакций, протекающих при температурах, близких к комнатной (энергия активации таких реакций 50-150 кДж/моль).); - наличие катализатора Катализатор - вещество, участвующее в реакции и изменяющее ее скорость, но остающееся неизменным после того, как химическая реакция заканчивается. Механизм действия катализаторов связан с тем, что они изменяют энергию активации реакции за счет образования промежуточных соединений., его природа и концентрация.








