Основные типы химических связей
Основными типами химических связей, отличающихся друг от друга электронным строением и механизмом взаимодействия связываемых атомов, являются ковалентная и ионная связи. Важное значение имеют также металлическая и водородная связи.
- Образование ковалентной или ионной связи в значительной степени определяется разностью электроотрицательностей (Δχ) связывемых атомов:
где χА и χВ – электроотрицательности атомов А и В.
С учётом приблизительности диапазонов значений Δχ это можно представить в виде схемы:

* ПримечаниеСходство свойств неполярных и слабополярных связей позволяет объединить их в одну группу.
- металлическая связь — это химическая связь между положительными ионами металлов, осуществляемая за счет притяжения электронов, свободно перемещающихся по кристаллу.
Пример: делокализация
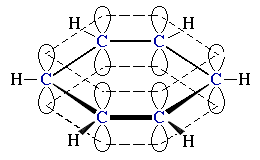 C6H6
(модель
C6H6
(модель ).
Водородные связи занимают особое место в органической химии. Физические и некоторые химические свойства органических соединений зависят от наличия этих связей. Водородные связи играют важную роль в формировании пространственной структуры и свойствах биополимеров — белков, нуклеиновых кислот (ДНК, РНК), полисахаридов (углеводов).
).
Водородные связи занимают особое место в органической химии. Физические и некоторые химические свойства органических соединений зависят от наличия этих связей. Водородные связи играют важную роль в формировании пространственной структуры и свойствах биополимеров — белков, нуклеиновых кислот (ДНК, РНК), полисахаридов (углеводов).
- Водородная связь — довольно слабое электростатическое взаимодействие между атомом водорода, связанным с электроотрицательным атомом (например, H—O), и таким же или другим электроотрицательным элементом (фтором, кислородом, азотом).








