Ковалентная связь считается локализованной, если её электронная пара находится в поле двух атомных ядер и связывает только два атома.
Делокализация π-связей характерна для сопряжённых систем, к которым относятся соединения с чередующимися кратными и одинарными связями:
| Сопряжённые системы | Несопряжённые системы | |
|
CH2=CH–CH=CH2 CH2=CH–C≡CH |
CH2=CH–СН2–CH=CH2 HC≡C–СН2–CH=CH2 | |
| Делокализованные π-связи | Локализованные π-связи |
Цепь сопряжeния может быть открытой или замкнутой и содержать не только атомы углерода, но и гетероатомы

Делокализацию π-связей в открытой системе сопряжения можно показать с помощью атомно-орбитальной модели молекулы на примере бутадиена-1,3



Связывающая π-МО
Делокализация π-электронов приводит к тому, что в сопряжённой системе связи становятся нецелочисленными (дробными), то есть ни двойными или тройными, ни одинарными. Иначе говоря, связи имеют нецелочисленный порядок.Порядок связи — это число электронных пар, участвующих в ее образовании.
Порядок простой связи равен 1, двойной – 2, тройной – 3.
Порядок делокализованных связей имеет промежуточные дробные значения.
В бутадиене-1,3 порядок связей C1–C2 и C3–C4 равен 1,894, а связи C2–C3 – 1,447. Соответственно, длина делокализованных связей имеет промежуточное значение между длинами одинарных и кратных связей.
Типичным примером делокализации связей в замкнутой (циклической) системе сопряжения является бензол C6H6

Схема делокализации и модель молекулы.
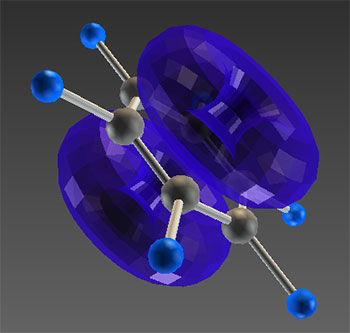
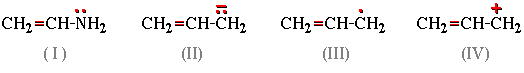

- Распределение электронов в сопряжённых системах (молекулах, ионах, свободных радикалах) можно представить с помощью резонансных структур.
- Соединения с делокализованными π-связями обладают повышенной термодинамической стабильностью по сравнению с несопряжёнными системами.
Например, выигрыш в энергии за счет π-сопряжения (энергия сопряжения Eπ) для бутадиена-1,3
CH2=CH–CH=CH2 составляет 15кДж/моль, а для циклической π-системы бензола C6H6 эта величина достигает 150,5 кДж/моль. - Подвижность π-электронов делокализованных связей определяет высокую поляризуемость молекул, что влияет на химические и физические свойства вещества.
- Молекулы с делокализованными π-связями имеют относительно низкую энергию возбуждения, обусловленную переносом электрона с высшей занятой π-молекулярной орбитали (ВЗМО) на низшую вакантную (НВМО). Разность энергий ВЗМО и НВМО (энергия возбуждения) уменьшается с увеличением числа делокализованных π-связей.
- При достаточно большом числе сопряжённых π-связей (обычно от 7 и выше) проявляется способность соединений к поглощению света в видимой части спектра. Этим обусловлена окраска природных пигментов и синтетических красителей.
К таким соединениям относится β-каротин (от лат. carota – морковь) — жёлто-оранжевый растительный пигмент, который cодержится в листьях всех растений, в корнеплодах моркови, ягодах шиповника и др.:

Другой пример: ликопин
Система делокализованных связей всегда входит в структуру молекул окрашенных веществ. В химии красителей такие сопряжённые системы называются хромофорами (от греч. chroma — цвет и phorós — несущий). (от лат. Lycopersicum – вид томатов) — ярко-красный пигмент. Содержится в помидорах, арбузах, грейпфрутах и других красных фруктах и овощах.
(от лат. Lycopersicum – вид томатов) — ярко-красный пигмент. Содержится в помидорах, арбузах, грейпфрутах и других красных фруктах и овощах.Полярные функциональные группы (например, -OH, -NH2, -N(СH3)2, -SO3H), не имеющие собственного цвета, но присоединённые к хромофору и вступающие с ним в сопряжение, углубляют цвет или изменяют его оттенок. Такие группы называют ауксохромами (от греч. aὐxó — увеличивать, усиливать).
-
Полимеры, макромолекулы которых содержат множество сопряжённых кратных связей (полисопряжённые полимеры), проявляют свойства полупроводников и электропроводящих материалов.
Проводимость в полисопряжённых полимерах имеет электронный характер, носителями тока являются подвижные π-электроны, принадлежащие всей системе в целом. За сходство механизма электропроводности с металлами такие полимеры называют "органическими металлами", в которых роль электронов металлической связи выполняют π-электроны делокализованных связей.
Простейший представитель сопряжённых полиенов — полиацетилен (полимер ацетилена):n CH≡CH (CH=CH–)n
(CH=CH–)n...–CH=CH–CH=CH–CH=CH–CH=CH–...
Удельная электропроводность 10–7–10–3 Ом–1·м–1.Органические металлы могут использоваться в качестве неметаллических проводников, сверхпроводников, электродов в химических источниках тока, для записи и преобразования информации и др.
Важность достижений в этой области отмечена Нобелевской премией по химии 2000 г. «За открытие проводимости в полимерах» (А. Хигер, А. Мак-Диармид, Х. Ширакава).








