Согласно этой теории реальная молекула или частица описывается набором резонансных структур, которые отличаются друг от друга только распределением электронов.
Резонансные структуры (называемые также мезомерными, граничными или каноническими) изображаются в виде электронных формул Льюиса с целочисленными (локализованными) связями. Реальное распределение электронов в сопряжённой системе не соответствует ни одной из них, а представляет нечто промежуточное между ними. Наложение резонансных структур указывается специальным символом – двусторонней (резонансной) стрелкой "↔".
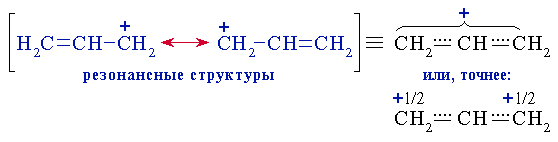
Аллил-катион представлен двумя равноценными резонансными структурами. Поэтому можно считать, что полный заряд +1 распределён поровну (по +1/2) между крайними атомами углерода.
- Установите, какой тип сопряжения (π,π- или р,π-) реализуется в рассматриваемой частице, используя ее атомно-орбитальную модель. Это позволит определить, какие атомы входят в π-систему, и может ли неподелённая электронная пара гетероатома участвовать в сопряжении.
- Исходя из электроотрицательности атомов, определите направление смещения электронов в π-системе и покажите это смещение изогнутыми стрелками.
- Изобразите резонансные структуры (формулы Льюиса), придерживаясь направления смещения электронов, указанных стрелками, и соблюдая правило октета.
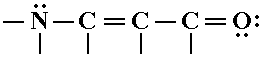 может быть представлена в виде следующей атомно-орбитальной модели:
может быть представлена в виде следующей атомно-орбитальной модели:
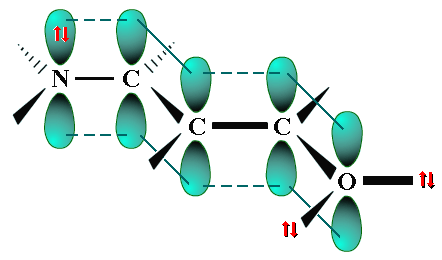
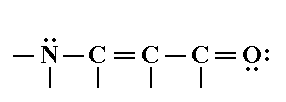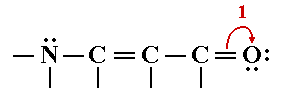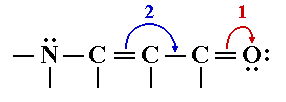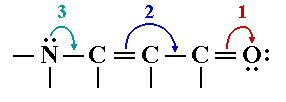
Анимация
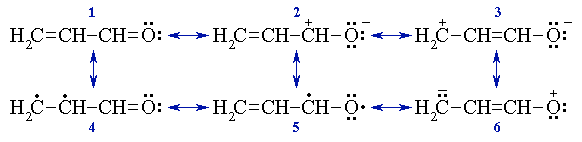
Перемещая электроны по направлению стрелок, последовательно строим соответствующие резонансные структуры:
- действуя в направлении стрелки 1, получаем структуру I;
- суммарное действие стрелок 1 и 2 ведёт к структуре II;
- результатом действия стрелок 1, 2 и 3 является структура III.
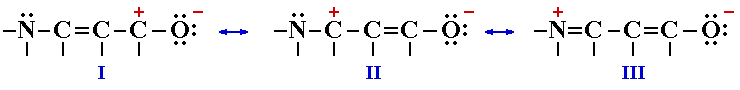
Наименьшей энергией обладают такие резонансные структуры сопряжённой системы, которые:
- включают наибольшее число π-связей,
- имеют отрицательный заряд на наиболее электроотрицательном атоме, а положительный – на наименее электроотрицательном,
- отличаются наибольшим расстоянием между одноименными зарядами и наименьшим между разноименными.
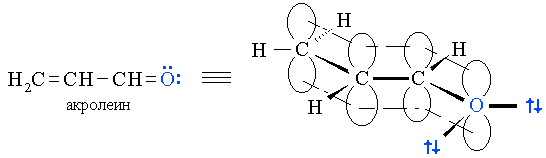
Энергия основного состояния сопряжённой системы всё же меньше, чем энергия любой существенной резонансной структуры. Разность между этими энергиями называют энергией сопряжения (делокализации, резонанса, мезомерии). Эта энергия тем выше, а энергия основного состояния тем ниже (вещество устойчивее), чем больше число резонансных структур с равным запасом энергии.
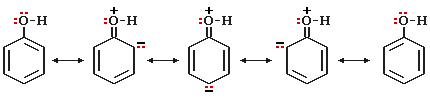
Набор правильно построенных резонансных структур позволяет установить места наибольшей локализации заряда или неспаренного электрона, то есть те реакционные центры, по которым возможна атака соответствующим реагентом.Например, в случае фенола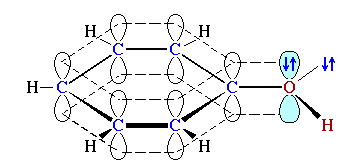
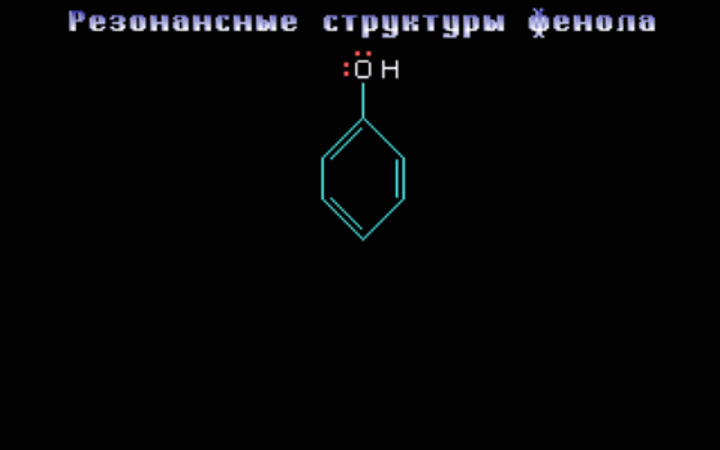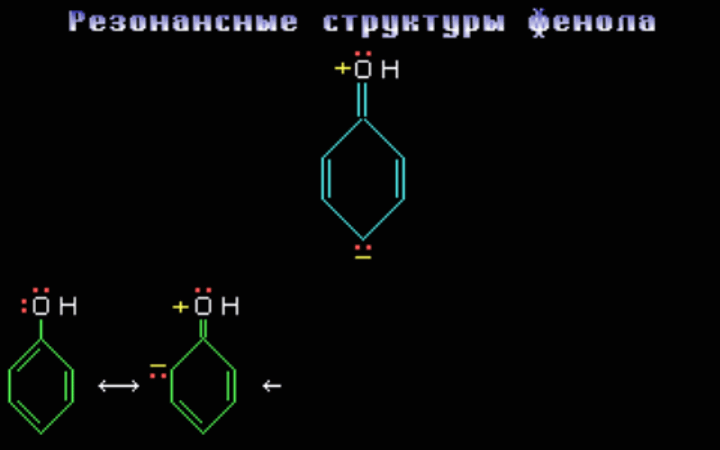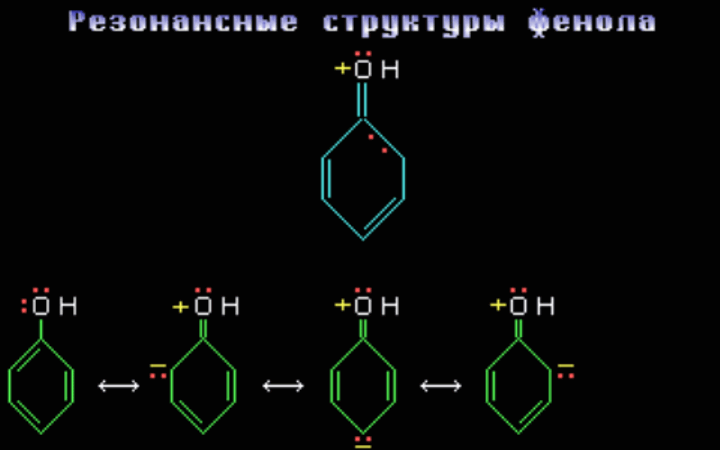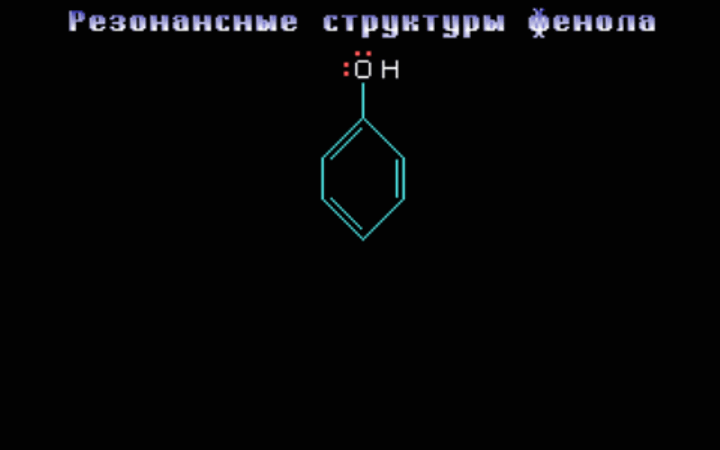
АО-модель фенола C6H5OH C6H5OH основное состояние может быть представлено пятью существенными структурами, которые показывают возможные положения электронной пары в данной сопряжённой системе.
Анимация