Форма и энергия атомных орбиталей
Атомные орбитали (АО) разных типов отличаются друг от друга формой и энергией и обозначаются символами: s, p, d, f и т.д.
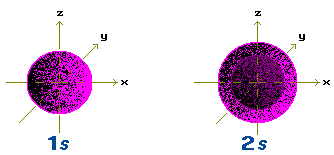
Органические вещества состоят в основном из элементов 2-го и 3-го периодов, валентные электроны которых находятся на s- и р-АО.Атомные орбитали s-типа имеют форму сферы:
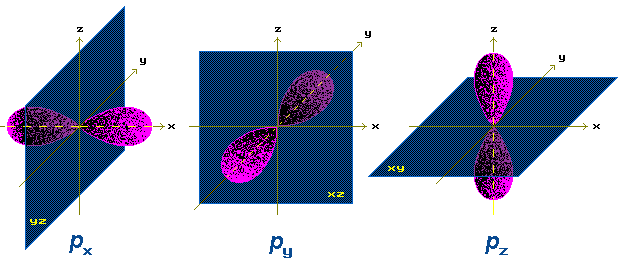
р-АО имеют форму объемной восьмерки (гантели), направленной по оси x, y или z.
Энергия орбитали возрастает по мере удаления электрона от ядра атома (т.е. с увеличением номера электронного уровня).
Так, энергия s-АО увеличивается в ряду: 1s < 2s < 3s и т.д. Аналогично изменяется энергия р-АО: 2p < 3p < 4p и т.д.Внутри одного энергетического уровня энергия АО возрастает от s-АО к р-АО:








