Взаимное влияние атомов в молекуле фенола проявляется не только в особенностях поведения гидроксигруппы, но и в большей реакционной способности бензольного ядра.
 Гидроксильная группа повышает электронную плотность в бензольном кольце, особенно, в орто- и пара-положениях за счёт
Гидроксильная группа повышает электронную плотность в бензольном кольце, особенно, в орто- и пара-положениях за счёт
Галогенирование. Фенол легко при комнатной температуре взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола (качественная реакция на фенол):
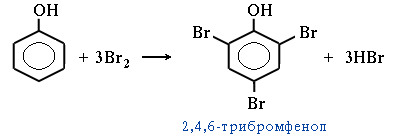
 Видеоопыт "Взаимодействие фенола с бромной водой".
Видеоопыт "Взаимодействие фенола с бромной водой".
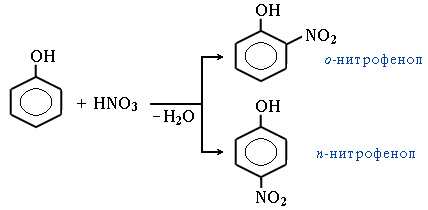
Нитрование. Под действием 20%-ной азотной кислоты HNO3
Электрофильный центр – атом N+ фенол легко превращается в смесь орто- и пара-нитрофенолов:

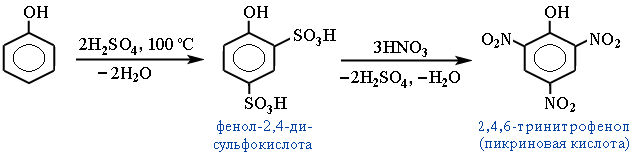
Конденсация с альдегидами и кетонами. Практическое значение имеют реакции
конденсацииРеакция конденсации – исторически сложившийся термин, который означает химическую реакцию, приводящую к усложнению углеродного скелета. При конденсации из двух относительно простых молекул образуется новое, более сложное соединение.
Конденсация, идущая с образованием высокомолекулярных соединений, называется поликонденсацией. фенола с формальдегидом H2C=O и с ацетоном (CH3)2C=O. Эти реакции идут по типу электрофильного замещения в бензольном кольце с участием орто- и пара-положений. Электрофильным реагентом является альдегид или кетон за счёт пониженной электронной плотности (частичного положительного заряда δ+) на атоме углерода в полярной карбонильной группе >Cδ+=Oδ–.
- Фенол с формальдегидом H2C=O при конденсации образуют фенолоформальдегидные смолы.
История открытия и практическое значение реакции
Ещё в 1872 г. Адольф Байер обнаружил, что при взаимодействии фенола с формальдегидом образуются смолообразные продукты, позднее названные фенолоформальдегидными смолами. Важное практическое значение эта реакция приобрела после открытия Лео Бакеландом (1909 г.) способа получения исторически первой синтетической пластмассы — бакелита, изделия из которого стали производиться в крупных промышленных масштабах. Этот нерастворимый, неплавкий, не проводящий электричество и относительно недорогой полимерный материал нашел широкое применение. Неотверждённые фенолоформальдегидные смолы являются основным видом связующих веществ в стеклопластиках, древесно-волокнистых (ДВП) и древесно-стружечных плитах (ДСП), а также в клеях типа БФ-2, БФ-6 и др.
1. Основание (например, HО– в составе NaOH) активирует молекулу фенола превращением ее в фенолят-анион С6Н5О–.
2. В случае кислотного катализа формальдегид H2C=O, присоединяя протон H+, превращается в более активный электрофильный реагент H2C+–OH.

Для фенола эта реакция идёт как электрофильное замещение (SE) в бензольном кольце,
а для формальдегида – как нуклеофильное присоединение (AdN) по связи Сδ+=Oδ–.

и так далее . . .
Образование линейного фенолоформальдегидного полимера схематически можно записать в следующем виде:

Формальная схема образования полимера (управляемая анимация)
Управляемая анимация
 — бакелит (резит). Подробнее >>
— бакелит (резит). Подробнее >>
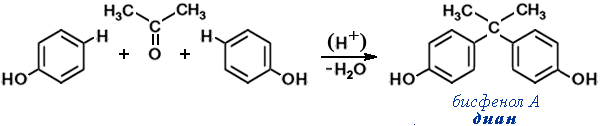
- Конденсация фенола с ацетоном (CH3)2C=O (реакция Дианина) имеет важное практическое значение как способ получения
бисфенола А — необходимого полупродукта в производстве эпоксидных смолЭпоксидные смолы — олигомеры, содержащие эпоксидные группы и способные под действием отвердителей образовывать сшитые полимеры. Наиболее важные представители — продукты поликонденсации эпихлоргидрина с бисфенолом А (дианом). и поликарбонатов,Поликарбонаты — сложные полиэфиры угольной кислоты и двухатомных спиртов или фенолов общей формулы(-O-R-O-CO-)n Наибольшее практическое значение имеют ароматические поликарбонаты, в первую очередь, поликарбонат на основе бисфенола А (диана). широко применяемых в различных областях промышленности и техники.
Модель молекулы бисфенола А

Схема синтеза


Реакции I и II — электрофильное замещение в бензольном кольце фенола с участием пространственно более доступного пара-положения. Кислотный катализ активирует электрофильные реагенты, превращая их в карбокатионы:

 .
.

Подробнее >>

Подробнее >>








