Простые эфиры
Простыми эфирами называют органические вещества, молекулы которых состоят из углеводородных радикалов, соединенных атомом кислорода: R–O–R', где R и R' – различные или одинаковые радикалы.
Простые эфиры рассматриваются как производные спиртов. Названия этих соединений состоят из названий радикалов и слова эфир (название класса). Для симметричных эфиров ROR используется приставка ди перед названием радикала, а в названиях несимметричных эфиров ROR' радикалы указываются в алфавитном порядке. Например, CH3OCH3 – диметиловый эфир; C2H5OCH3 – метилэтиловый эфир.
Симметричные простые эфиры R–O–R получают при межмолекулярной дегидратации спиртов.
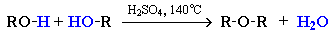
При этом в одной молекуле спирта разрывается связь О–Н, а в другой – связь С–О. Реакцию можно рассматривать как нуклеофильное замещение группы HО– (в одной молекуле спирта)
на группу RO– (от другой молекулы).
Эфиры несимметричного строения R–O–R' образуются при взаимодействии алкоголята и галогенуглеводорода (синтез Вильямсона). Например, метилэтиловый эфир можно получить из этилата натрия и хлорметана:
 C2H5OCH3 + NaCl
C2H5OCH3 + NaCl
В этой реакции происходит нуклеофильное замещение галогена (Cl–) на алкоксигруппу (C2H5O–).
Простые эфиры получают также присоединением спиртов и фенолов к ненасыщенным углеводородам.
- Присоединение к алкенам:
- Присоединение к алкинам с образованием виниловых эфиров (реакция винилирования):
- разложение под действием концентрированных иодоводородной или бромоводородной кислот
R–O–R' + HI  ROH + R'I
ROH + R'I - образование нестойких солей оксония (подобных солям аммония) в результате взаимодействия с сильными кислотами
R2O + HCl  [R2OH]+Cl-
[R2OH]+Cl- - диоксан
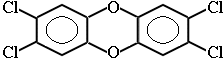
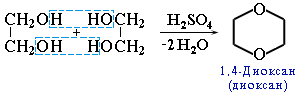 Диоксан (т. кип. 101 °С) – хороший растворитель, смешивается как с водой, так и с углеводородами. За эти качества его назвали "органической водой". Достаточно токсичен. Значительно более опасны галогенсодержащие дибензопроизводные диоксана. Например, печально известный диоксин (2,3,7,8-тетрахлордибензо-п-диоксин).
Диоксан (т. кип. 101 °С) – хороший растворитель, смешивается как с водой, так и с углеводородами. За эти качества его назвали "органической водой". Достаточно токсичен. Значительно более опасны галогенсодержащие дибензопроизводные диоксана. Например, печально известный диоксин (2,3,7,8-тетрахлордибензо-п-диоксин). - эпоксиды — соединения, содержащие эпоксидную группу
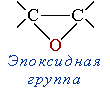 , отличающиеся от других простых эфиров высокой реакционной способностью вследствие напряжённости трёхчленного цикла и играющие важную роль в органическом синтезе и производстве эпоксидных смол.
, отличающиеся от других простых эфиров высокой реакционной способностью вследствие напряжённости трёхчленного цикла и играющие важную роль в органическом синтезе и производстве эпоксидных смол.
Для получения эпоксидов используются:- - реакции окисления алкенов
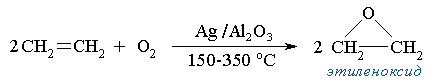 Каталитическое окисление этилена
Каталитическое окисление этилена
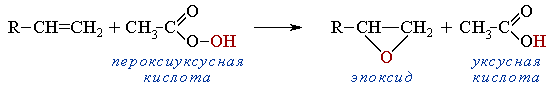
Окисление алкенов пероксикислотами в инертных растворителях (реакция Прилежаева)
- - дегидрогалогенирование галогенгидринов (галогеноспиртов) под действием оснований
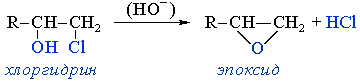 Этот процесс идёт как внутримолекулярный синтез Вильямсона, где гидроксид-ион играет роль нуклеофильного агента, а галоген — уходящей группы
Этот процесс идёт как внутримолекулярный синтез Вильямсона, где гидроксид-ион играет роль нуклеофильного агента, а галоген — уходящей группы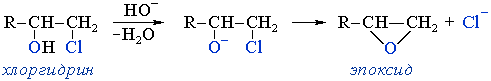
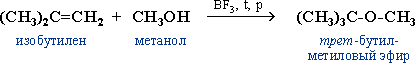
Реакция идет по правилу Марковникова (электрофильный механизм). Роль катализатора BF3 – образование электрофила H+ в составе комплекса H+[CH3OBF3]–, получаемого при взаимодействии спирта и трифторида бора.
Присоединение фенолов к алкенам происходит в более жестких условиях и сопровождается побочными реакциями (алкилирование ароматического кольца).

Механизм реакции – нуклеофильное присоединение по тройной связи. Нуклеофил – феноксид-анион ArO– (или алкоксид-анион RO–), образующийся из фенола (или спирта) под действием щелочи.
Простые эфиры имеют более низкие температуры кипения и плавления, чем изомерные им спирты. Эфиры практически не смешиваются с водой. Это объясняется тем, что простые эфиры не образуют водородных связей, так как в их молекулах отсутствуют полярные связи