Строение гидроксильной группы -ОН
Свойства спиртов и фенолов определяются строением гидроксильной группы -OH, характером ее химических связей, строением углеводородных радикалов и их взаимным влиянием.
Связи О–Н и С–О – полярные ковалентные. Это следует из различий в электроотрицательности кислорода (3,5), водорода (2,1) и углерода (2,4). Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
 |
Атому кислорода в спиртах R-O-H свойственна sp3-гибридизация. В образовании его связей с атомами C и H участвуют две 2sp3-атомные орбитали, валентный угол C–О–H близок к тетраэдрическому (около 108,5°). Каждая из двух других 2sp3-АО кислорода занята неподеленной парой электронов. |
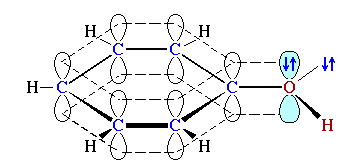 АO-модель молекулы фенола C6H5OH |
В фенолах Ar-O-H под влиянием π-электронной системы бензольного кольца для атома кислорода предпочтительней sp2-гибридизация.
При этом одна из неподеленных электронных пар находится на негибридной |
Электронные эффекты гидроксильной группы -OH в спиртах и фенолах


Сравните распределение электронной плотности (заряды на атомах) в молекулах метанола и фенола.








