Присоединение большинства реагентов по двойной связи С=О происходит как ионная реакция по механизму нуклеофильного присоединения AN (от англ. nucleophile addition).
- Присоединение циановодородной (синильной) кислоты HCN:
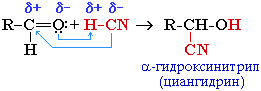
Нуклеофил — группа :CN– в составе молекулы HCN.Эта реакция используется для удлинения углеродной цепи, а также для получения α-гидроксикислот R-CH(COOH)OH по схеме:R–CH(CN)OH + H2O  R–CH(COOH)OH + NH3
R–CH(COOH)OH + NH3 - Присоединение спиртов с образованием полуацеталей (катализатор – кислота или основание):
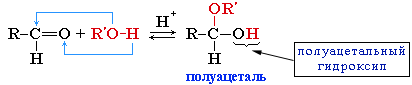
Нуклеофил — молекула спирта с неподеленной парой электронов на атоме кислорода.- Полуацетали — соединения, в которых атом углерода связан с гидроксильной (-ОН) и алкоксильной (-OR) группами
R–CH(OR)ОН.
Взаимодействие полуацеталя с еще одной молекулой спирта (в присутствии кислоты) приводит к замещению полуацетального гидроксила на алкоксильную группу OR' и образованию ацеталя: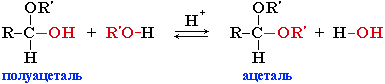 Механизм реакции — нуклеофильное замещение группы OH на OR.
Механизм реакции — нуклеофильное замещение группы OH на OR.- Ацетали – соединения, в которых атом углерода связан с двумя алкоксильными (-OR) группами
R–CH(OR)2. - Присоединение реактива Гриньяра (алкилмагнийгалогенида R–MgHal) с образованием спиртов
Присоединение реактива Гриньяра к альдегидам и кетонам Реактивы Гриньяра – алкилмагнийгалогениды R–MgHal – смешанные магниевые соли галогеноводородных кислот HHal и алканов RH, получаемые при взаимодействии магния с алкилгалогенидом RHal в среде безводного эфира. Реактивы Гриньяра служат источниками карбанионов R:–, являющихся сильными нуклеофилами и основаниями.
- Присоединение R-MgHal к формальдегиду приводит к образованию первичных спиртов:
- Из альдегидов получаются вторичные спирты:
- В реакции с кетонами образуются третичные спирты:



- Взаимодействие с аммиаком и его производными
Взаимодействие альдегидов и кетонов с аммиаком и его производными Аммиак NH3 и его производные NH2X реагируют с альдегидами и кетонами по схеме:R2C=O + NH2X  R2C=NH–X + H2O
R2C=NH–X + H2O
R = H, Alk, Ar;
X = H, Alk, Ar, OH, NH2, NHC6H5, NHCONH2 и т.п.Реакция идет в две основные стадии. Сначала образуется продукт нуклеофильного присоединения, который затем вследствие неустойчивости отщепляет воду. Поэтому данный процесс в целом классифицируют как реакцию присоединения-отщепления.
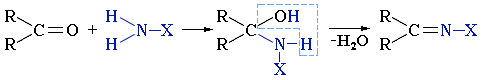
Формально эта реакция выглядит как замещение атома кислорода на группу N-X.1. При взаимодействии альдегидов и кетонов с аммиаком образуются имины:
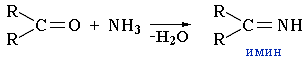
- Реакция карбонильных соединений с аммиаком может сопровождаться циклизацией продуктов присоединения. Например, взаимодействие аммиака с формальдегидом, как показал А.М. Бутлеров, приводит к образованию гексаметилентетрамина, известного как медицинский препарат уротропин:
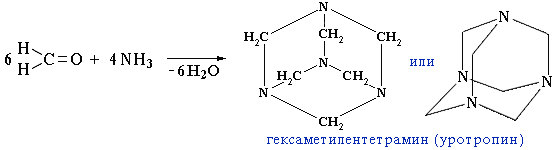
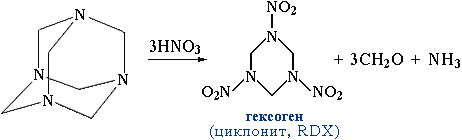
При нагревании идет обратная реакция, поэтому уротропин часто используется как источник формальдегида. Уротропин входит в состав "сухого" горючего для применения в быту. Нитрованием гексаметилентетрамина получают мощное взрывчатое вещество гексоген.
2. В реакциях с аминами RNH2 получают замещённые имины (основания Шиффа):
R2C=O + R'NH2  R2C=N–R' + H2O
R2C=N–R' + H2O3. Другие производные аммиака NH2X (гидроксиламин, гидразин, фенилгидразин, семикарбазид и т.п.) в реакциях с карбонильными соединениями образуют соответствующие продукты (оксимы, гидразононы, азины, фенилгидразоны, семикарбазоны):

- Присоединение гидросульфитов:










 RO– + H2O
RO– + H2O Фрацузский химик-органик, член Парижской АН (с 1926). Ученик Ф.А. Барбье. Родился в Шербуре. Окончил Лионский университет (1893). В 1900-1909 работал там же, с 1909 - в университете Нанси (с 1910 профессор). В годы первой мировой войны - в военно-химической лаборатории в Сорбонне. В 1917-1918 читал лекции в Милонском институте (США). В 1919-1935 вновь в Лионском университете, с 1921 одновременно директор Школы химической промышленности в Лионе. Основатель 23-томного издания "Руководство по органической химии". Член ряда Академий наук и научных обществ. Лауреат Нобелевской премии (1912).
Фрацузский химик-органик, член Парижской АН (с 1926). Ученик Ф.А. Барбье. Родился в Шербуре. Окончил Лионский университет (1893). В 1900-1909 работал там же, с 1909 - в университете Нанси (с 1910 профессор). В годы первой мировой войны - в военно-химической лаборатории в Сорбонне. В 1917-1918 читал лекции в Милонском институте (США). В 1919-1935 вновь в Лионском университете, с 1921 одновременно директор Школы химической промышленности в Лионе. Основатель 23-томного издания "Руководство по органической химии". Член ряда Академий наук и научных обществ. Лауреат Нобелевской премии (1912).
