Строение моносахаридов
Структурные формулы моносахаридов часто представляют в виде незамкнутой (открытой) углеродной цепи с карбонильной (оксо) группой: 
Подобные структуры называют оксо-формой
или открытой цепной формой моносахаридов.
Структурная изомерия
Альдозы (альдегиды), кетозы (кетоны) и их циклические формы (полуацетали) одинакового состава являются межклассовыми изомерами. Например:
Разнообразие моносахаридов обусловлено главным образом различиями в пространственном строении и проявлении оптической изомерии. Например, формуле С6Н12О6 в открытой форме соответствуют 16 стереоизомерных альдогексоз (8 пар оптических изомеров) и 8 кетогексоз (4 пары оптических изомеров). Это связано с наличием в данных молекулах нескольких асимметрическихАсимметрический атом — тетраэдри-ческий sp3-атом, связанный с четырьмя различными атомами или атомными группами. углеродных атомов и различным расположением гидроксигрупп и атомов водорода при этих атомах.
Открытые формы моносахаридов изображают в виде проекций (проекционных формул Фишера),При построении проекции Фишера по вертикали располагают главную углеродную цепь (вертикальные связи должны быть направлены ЗА плоскость рисунка, а горизонтальные - ПЕРЕД плоскостью); вверху должен находиться атом углерода с наименьшим номером по номенклатуре IUPAC. Напомним, что при нумерации главной цепи атом углерода старшей функциональной группы (в данном случае >C=O) получает наименьший номер. отражающих положение OH-групп относительно главной углеродной цепи. Например, глюкоза и фруктоза существуют в форме оптических изомеров, которые можно представить проекционными формулами (асимметрические атомы углерода обычно не изображаются):
Для большинства природных моносахаридов характерна D-конфигурация. Поэтому часто символ D- в названиях углеводов опускается: глюкоза (D-глюкоза), фруктоза (D-фруктоза) и т.п.
Наибольшее распространение в природе имеет D-глюкоза (глюкоза). Этот изомер является практически единственным из большого числа гексоз, который встречается в свободном состоянии и составляет основу важнейших полисахаридов (крахмала, гликогена и целлюлозы).
Альдозы (альдегиды), кетозы (кетоны) и их циклические формы (полуацетали) одинакового состава являются межклассовыми изомерами. Например:

Разнообразие моносахаридов обусловлено главным образом различиями в пространственном строении и проявлении оптической изомерии. Например, формуле С6Н12О6 в открытой форме соответствуют 16 стереоизомерных альдогексоз (8 пар оптических изомеров) и 8 кетогексоз (4 пары оптических изомеров). Это связано с наличием в данных молекулах нескольких асимметрическихАсимметрический атом — тетраэдри-ческий sp3-атом, связанный с четырьмя различными атомами или атомными группами. углеродных атомов и различным расположением гидроксигрупп и атомов водорода при этих атомах.
Открытые формы моносахаридов изображают в виде проекций (проекционных формул Фишера),При построении проекции Фишера по вертикали располагают главную углеродную цепь (вертикальные связи должны быть направлены ЗА плоскость рисунка, а горизонтальные - ПЕРЕД плоскостью); вверху должен находиться атом углерода с наименьшим номером по номенклатуре IUPAC. Напомним, что при нумерации главной цепи атом углерода старшей функциональной группы (в данном случае >C=O) получает наименьший номер. отражающих положение OH-групп относительно главной углеродной цепи. Например, глюкоза и фруктоза существуют в форме оптических изомеров, которые можно представить проекционными формулами (асимметрические атомы углерода обычно не изображаются):

Для большинства природных моносахаридов характерна D-конфигурация. Поэтому часто символ D- в названиях углеводов опускается: глюкоза (D-глюкоза), фруктоза (D-фруктоза) и т.п.
Наибольшее распространение в природе имеет D-глюкоза (глюкоза). Этот изомер является практически единственным из большого числа гексоз, который встречается в свободном состоянии и составляет основу важнейших полисахаридов (крахмала, гликогена и целлюлозы).
Однако не все свойства моносахаридов согласуются с открытой цепной формой строения. Так, моносахариды не участвуют в некоторых реакциях, типичных для карбонильной группы: не дают качественной реакции с фуксинсернистой кислотой, не реагируют с гидросульфитом натрия

В данную реакцию моносахариды не вступают. NaHSO3). Одна из гидроксигрупп отличается повышенной реакционной способностью и её замещение (например, на группу -OR) приводит к исчезновению свойств альдегида (или кетона). Следовательно, моносахаридам, кроме приведенных выше формул, свойственна также иная, изомерная структура, которая может возникнуть при внутримолекулярной реакции между функциональными группами молекулы (ОН, С=О).
В разделе "Альдегиды и кетоны" приведена реакция присоединения спирта к альдегиду с образованием полуацеталяПолуацеталь — органическое соедине-ние, в котором атом углерода связан с ОН-группой и группой OR (где R — органический радикал):

За счёт реакции между этими функциональными группами и происходит внутримолекулярная циклизация. При этом возможно образование двух стереоизомерных циклических полуацеталей: α- и β-форм, отличающихся пространственным положением полуацетальной гидроксильной группы, полученной в результате реакции. Эта гидроксильная группа в химии углеводов называется гликозидным (полуацетальным) гидроксилом.
Различные формы возникают вследствие того, что альдегидная группа из-за поворота вокруг σ-связи С(1)–С(2) обращается к атакующему реагенту (гидроксильной группе) то одной стороной плоскости двойной связи С=О, то другой.
Примечание: здесь и далее под термином "глюкоза" подразумевается D-глюкоза.Оптические изомеры глюкозы
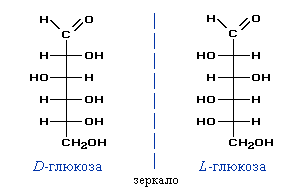
Поскольку для большинства природных моносахаридов характерна D-конфигурация, символ D- в названиях углеводов часто опускается: глюкоза (D-глюкоза), фруктоза (D-фруктоза) и т.п.
Примечание: здесь и далее под термином "глюкоза" подразумевается D-глюкоза.


Механизм внутримолекулярной реакции — нуклеофильное присоединение.
Нуклеофил — атом кислорода с неподелённой парой электронов при С(5).
Образование β-глюкозы
Нуклеофил — атом кислорода с неподелённой парой электронов при С(5).

Следовательно, моносахариды могут существовать в различных формах: открытой цепной (оксо-форме) и циклической (полуацетальной). В растворах моносахаридов эти формы находятся в равновесии друг с другом. Например, в водном растворе глюкозы существуют следующие структуры (полуацетальный гидроксил выделен цветом):

Если α- или β-положение полуацетального гидроксила не установлено,
его связь с циклом обозначают символом ~ (тильда). Пример.
(связи С-Н не показаны)
Другая форма записи (проекции Фишера)
его связь с циклом обозначают символом ~ (тильда). Пример.

(связи С-Н не показаны)

В незначительных количествах (~0,1%) присутствуют также полуацетали в виде α- и β-форм 5-ти членных циклов, образующихся при циклизации глюкозы с участием ОН-группы при атоме С(4). Примечание.В названиях полуацеталей с 6-ти членным циклом используется суффикс пираноза по аналогии с 6-членным кислород-содержащим гетероциклом пиран (α-глюкоза → α-глюко-пираноза). Пятичленные циклические полуацетали обозначают суффиксом фураноза (в соответствии с 5-членным кислород-содержащим гетероциклом фуран). Например, полуацетальная форма фруктозы:
образующихся при циклизации глюкозы с участием ОН-группы при атоме С(4). Примечание.В названиях полуацеталей с 6-ти членным циклом используется суффикс пираноза по аналогии с 6-членным кислород-содержащим гетероциклом пиран (α-глюкоза → α-глюко-пираноза). Пятичленные циклические полуацетали обозначают суффиксом фураноза (в соответствии с 5-членным кислород-содержащим гетероциклом фуран). Например, полуацетальная форма фруктозы:
Подобное динамическое равновесие структурных изомеров называется таутомерией. Данный случай относится к цикло-цепной (цикло-оксо) таутомерии моносахаридов. Цикло-оксо-таутомерия позволила объяснить изменениеНапример, сначала в водном растворе  образующихся при циклизации глюкозы с участием ОН-группы при атоме С(4). Примечание.В названиях полуацеталей с 6-ти членным циклом используется суффикс пираноза по аналогии с 6-членным кислород-содержащим гетероциклом пиран (α-глюкоза → α-глюко-пираноза). Пятичленные циклические полуацетали обозначают суффиксом фураноза (в соответствии с 5-членным кислород-содержащим гетероциклом фуран). Например, полуацетальная форма фруктозы:
образующихся при циклизации глюкозы с участием ОН-группы при атоме С(4). Примечание.В названиях полуацеталей с 6-ти членным циклом используется суффикс пираноза по аналогии с 6-членным кислород-содержащим гетероциклом пиран (α-глюкоза → α-глюко-пираноза). Пятичленные циклические полуацетали обозначают суффиксом фураноза (в соответствии с 5-членным кислород-содержащим гетероциклом фуран). Например, полуацетальная форма фруктозы:
Это явление, обнаруженное еще до установления строения моносахаридов, долгое время не находило объяснения. Сейчас известно, что причина мутаротации заключается в установлении равновесия между таутомерными формами моносахаридов.).
Таким образом, хотя моносахариды часто относят к полигидроксикарбонильным соединениям, в действительности же как в твердом состоянии, так и в растворе (не менее чем на 99,9%) они существуют в циклической полуацетальной форме. Следовательно, более точным является определение:
Моносахариды — это циклические полуацетали полигидроксикарбонильных соединений.
Циклические α- и β-формы глюкозы являются пространственными изомерами, отличающимися положением полуацетального гидроксила относительно плоскости кольца. В α-глюкозе этот гидроксил находится в транс-положении к гидроксиметильной группе

С учётом пространственного строения наиболее устойчивой формы шестичленного цикла 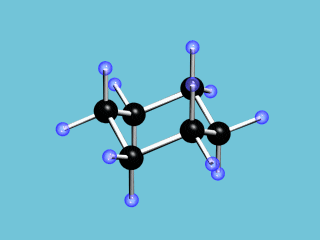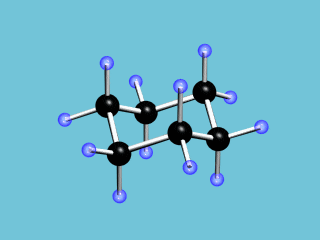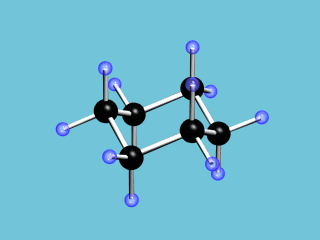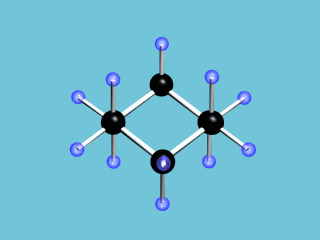 формулы этих изомеров имеют вид:
формулы этих изомеров имеют вид:
 формулы этих изомеров имеют вид:
формулы этих изомеров имеют вид:
• рибоза – структурный компонент рибонуклеиновых кислот (РНК);
– структурный компонент рибонуклеиновых кислот (РНК);
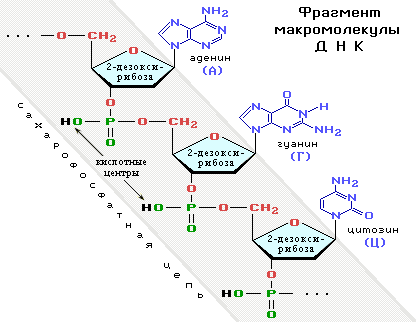
• дезоксирибоза (точнее, 2-дезоксирибоза, в которой у атома С(2) отсутствует гидроксигруппа) – структурный компонент ДНК (дезоксирибонуклеиновых кислот)
(точнее, 2-дезоксирибоза, в которой у атома С(2) отсутствует гидроксигруппа) – структурный компонент ДНК (дезоксирибонуклеиновых кислот)
• фруктоза – составная часть дисахарида сахарозы, в свободном виде содержится в пчелином меде и сладких плодах.
– составная часть дисахарида сахарозы, в свободном виде содержится в пчелином меде и сладких плодах.
 – структурный компонент рибонуклеиновых кислот (РНК);
– структурный компонент рибонуклеиновых кислот (РНК);• дезоксирибоза
 (точнее, 2-дезоксирибоза, в которой у атома С(2) отсутствует гидроксигруппа) – структурный компонент ДНК (дезоксирибонуклеиновых кислот)
(точнее, 2-дезоксирибоза, в которой у атома С(2) отсутствует гидроксигруппа) – структурный компонент ДНК (дезоксирибонуклеиновых кислот)

• фруктоза
 – составная часть дисахарида сахарозы, в свободном виде содержится в пчелином меде и сладких плодах.
– составная часть дисахарида сахарозы, в свободном виде содержится в пчелином меде и сладких плодах.








