Химические свойства карбоновых кислот
В молекулах карбоновых кислот можно выделить ряд реакционных центров, определяющих возможные реакции с участием как карбоксильной группы, так и углеводородного радикала.
Реакционные центры карбоксильной группы
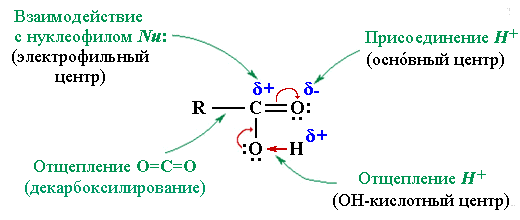

- ОН-кислотный центр определяет кислотные свойства (способность отщеплять H+)
При действии основанийОснование — частица (анион или моле-кула) с неподелённой электронной парой, способная присоединить протон H+ (HO–, H2O, RO–, NH3, RNH2 и т.п.).
Таким образом, основание — акцептор протона. связь О—Н разрывается гетеролитически с отрывом протона H+: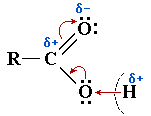
R–COOH + H2O  R–COO– + H3O+
R–COO– + H3O+
R–COOH + NaOH R–COO–Na+ + H2O
R–COO–Na+ + H2O - С участием электрофильного центра (атома углерода Cδ+ карбоксильной группы) происходят реакции нуклеофильного замещения группы –ОН в карбоновых кислотах с образованием функциональных производных (сложных эфиров, амидов, ангидридов, галогенангидридов и др.)
Реакции с разрывом связи C—OH под действием нуклеофильного реагентаНуклеофильный реагент, или нуклео-фил (Nu:) — это частица (анион или молекула), имеющая неподеленную пару электронов на внешнем электронном уровне и способная передать эти электро-ны на образование ковалентной связи с другим атомом (кроме водорода) по донорно-акцепторному механизму. (Nu:) приводят к замещению ОН-группы на остаток Nu:
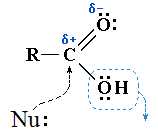
R–CO–Nu (Nu = OR, NH2, OCOR, Cl, Br и т.п.). По наличию группыR–CO– (ацил) эти соединения называют также ацильными производными. Нуклеофильному замещению ОН-группы способствует кислотный катализ, активирующий электрофильный центр Cδ+ и облегчающий отрыв ОН в составе Н2О. - Оснóвный центр — атом кислорода карбонильной группы с неподелённой электронной парой, способный присоединять протон H+. Это свойство используется при кислотном катализе реакций нуклеофильного замещения
Оснóвный центр C=O: участвует на стадии катализа при нуклеофильном замещении. В присутствии сильной кислоты (например, конц. H2SO4) в результате протонирования (присоединения H+) увеличивается эффективный положительный заряд на атоме углерода, что облегчает его атаку нуклеофильным реагентом.
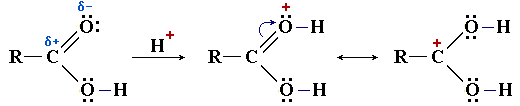
- Cвязь R—C является реакционным центром в реакциях декарбоксилирования — деструкции карбоновой кислоты с удалением карбоксильной группы в виде диоксида углерода CO2
Реакции по связи R—C, сопровождающиеся отщеплением CO2 (декарбоксилирование) идут по схеме:
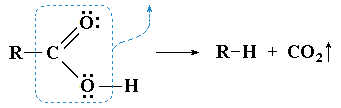
Примерами реакции декарбоксилирования могут служить:- получение нитрометана при нагревании нитроуксусной кислоты:
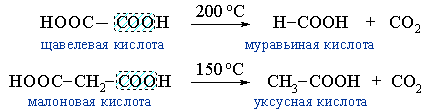
- образование муравьиной кислоты при нагревании щавелевой, или уксусной кислоты из малоновой:
- пиролиз карбоновых кислот при пропускании их паров (400–500°C) над оксидами тория, марганца или кадмия в синтезе карбонильных соединений:
2RCOOH → R2C=O + CO2 + H2O
RCOOH + HCOOH → RCH=O + CO2 + H2O - получение алканов по реакции Дюма (сплавление солей карбоновых кислот со щелочью):
R–COONa + NaOH и реакции Кольбе (электролиз солей карбоновых кислот): R–H + Na2CO3
R–H + Na2CO3
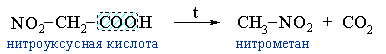
- Реакционные центры в углеводородном радикале R определяются электроноакцепторным характером карбоксильной группы СООН, выступющей в качестве заместителя. Реакции по углеводородному радикалу приводят к образованию замещённых карбоновых кислот.
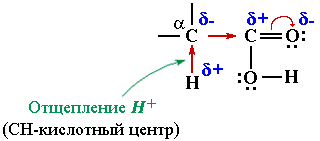 Реакционным центром в радикалах предельных кислот является СН-кислотный центр. Под влиянием электроноакцепторной СООН-группы соседняя α-СН-связь радикала становится полярной Cδ––Hδ+. Это определяет возможность реакций замещения атома водорода в α-звене метильного, первичного или вторичного алкильного радикала. Кислоты с третичным радикалом, например, (CH3)3C–COOH
Реакционным центром в радикалах предельных кислот является СН-кислотный центр. Под влиянием электроноакцепторной СООН-группы соседняя α-СН-связь радикала становится полярной Cδ––Hδ+. Это определяет возможность реакций замещения атома водорода в α-звене метильного, первичного или вторичного алкильного радикала. Кислоты с третичным радикалом, например, (CH3)3C–COOH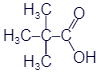
2,2-диметилпропановая
(триметилуксусная, пивалиновая)
кислота, в подобные реакции не вступают (из-за отсутствия α-СН-звена).
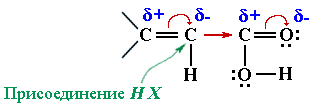 В радикалах непредельных кислот
В радикалах непредельных кислот 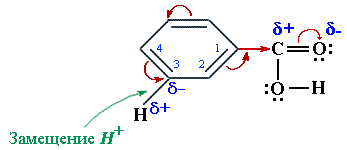 Реакционным центром в радикалах ароматических кислот (С6Н5–СООН) под влиянием –I и –М-эффектов группы СООН является наиболее полярная связь
Реакционным центром в радикалах ароматических кислот (С6Н5–СООН) под влиянием –I и –М-эффектов группы СООН является наиболее полярная связь
• Особое место в ряду карбоновых кислот занимает муравьиная кислота HCOOH.
H–COOH 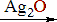
HO–COOH 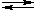 CO2↑ + H2O
CO2↑ + H2O
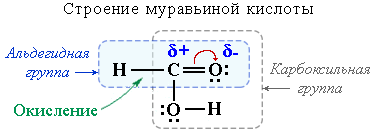 Это соединение можно рассматривать одновременно как кислоту и как альдегид. В отличие от других карбоновых кислот муравьиная кислота легко окисляется (даёт реакцию серебряного зеркала). Активным реакционным центром при этом является связь
Это соединение можно рассматривать одновременно как кислоту и как альдегид. В отличие от других карбоновых кислот муравьиная кислота легко окисляется (даёт реакцию серебряного зеркала). Активным реакционным центром при этом является связь
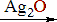
 CO2↑ + H2O
CO2↑ + H2O







 Французский химик и государственный деятель, член Парижской Академии наук (с 1832). Родился в Алесе. Работал фармацевтом в Женеве и одновременно учился в Женевском университете. В 1823-1840 работал в Политехнической школе в Париже (профессор с 1835). Одновременно преподавал в Сорбонне (1832-1868, с 1841 профессор), Центральной школе искусств и ремесел (1829-1852), одним из основателей которой он был, и в высшей медицинской школе (с 1839) в Париже. В 1849-1851 министр сельского хозяйства и коммерции. С 1868 секретарь Парижской Академии наук. Президент Французского химического общества (1859). Член ряда академий наук и научных обществ. Иностранный член-корреспондент Петербургской Академии Наук (с 1845).
Французский химик и государственный деятель, член Парижской Академии наук (с 1832). Родился в Алесе. Работал фармацевтом в Женеве и одновременно учился в Женевском университете. В 1823-1840 работал в Политехнической школе в Париже (профессор с 1835). Одновременно преподавал в Сорбонне (1832-1868, с 1841 профессор), Центральной школе искусств и ремесел (1829-1852), одним из основателей которой он был, и в высшей медицинской школе (с 1839) в Париже. В 1849-1851 министр сельского хозяйства и коммерции. С 1868 секретарь Парижской Академии наук. Президент Французского химического общества (1859). Член ряда академий наук и научных обществ. Иностранный член-корреспондент Петербургской Академии Наук (с 1845).

