Строение бензола. Ароматичность
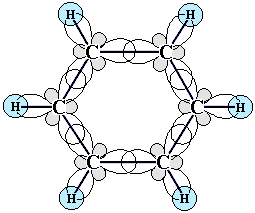
Бензол С6Н6 – родоначальник ароматических углеводородов, определящий их свойства.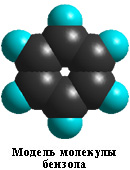 Каждый из шести атомов углерода в молекуле бензола находится в состоянии sp2-гибридизации (часть I. sp2-Гибридизация) и связан с двумя соседними атомами углерода и атомом водорода тремя σ-связями. Валентные углы между каждой парой этих связей равны 120°.
Таким образом, скелет σ-связей представляет собой правильный шестиугольник, в котором все атомы и все связи
Каждый из шести атомов углерода в молекуле бензола находится в состоянии sp2-гибридизации (часть I. sp2-Гибридизация) и связан с двумя соседними атомами углерода и атомом водорода тремя σ-связями. Валентные углы между каждой парой этих связей равны 120°.
Таким образом, скелет σ-связей представляет собой правильный шестиугольник, в котором все атомы и все связи


 ).
).
 Анимация
Анимация
Виртуальная (VRML) модель молекулы бензола.
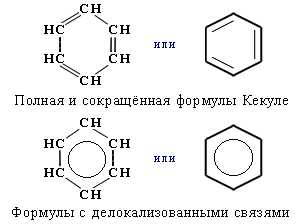 Все связи С–С в бензоле равноценны, их длина равна 0,140 нм, что соответствует промежуточному значению между длиной простой связи (0,154 нм) и двойной (0,134 нм). Это означает, что в молекуле бензола между углеродными атомами нет чисто простых и двойных связей, как в формуле циклогексатриена-1,3,5, предложенной в 1865 г. немецким химиком Ф. Кекуле.
Все связи С–С в бензоле равноценны, их длина равна 0,140 нм, что соответствует промежуточному значению между длиной простой связи (0,154 нм) и двойной (0,134 нм). Это означает, что в молекуле бензола между углеродными атомами нет чисто простых и двойных связей, как в формуле циклогексатриена-1,3,5, предложенной в 1865 г. немецким химиком Ф. Кекуле.
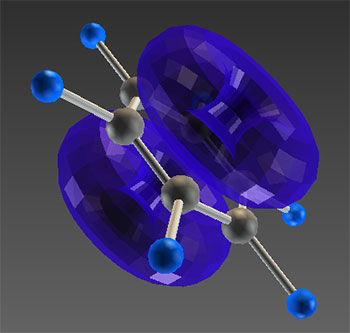
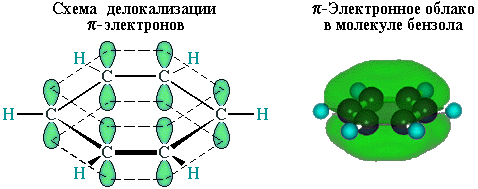
Выранивание С–С-связей обусловлено делокализацией π-электронов (часть I. Делокализованные π-связи) по схеме (анимация).
Поэтому структурную формулу бензола изображают в виде правильного шестиугольника (σ-скелет) и кружка внутри него, обозначающего делокализованные π-связи. Формула Кекуле также используется, но при этом учитывается, что она лишь условно передаёт строение молекулы бензола.
Установлено, что не все циклические сопряжённые соединения проявляют ароматичность. Некоторые из них уступают по устойчивости открытым (ациклическим) системам сопряжения. Например, циклобутадиен,Циклобутадиен C4H4
 имеющий в цикле 4 π-электрона, значительно менее устойчив, чем его ациклический аналог – бутадиен-1,3
имеющий в цикле 4 π-электрона, значительно менее устойчив, чем его ациклический аналог – бутадиен-1,3 CH2=CH–CH=CH2. Следовательно, вклад сопряжения Eπ в стабилизацию молекул зависит от числа участвующих в сопряжении π-электронов.
На основании изучения циклических сопряженных систем с использованием квантовохимических методов установлены критерии ароматичности (правило Хюккеля):
 имеющий в цикле 4 π-электрона, значительно менее устойчив, чем его ациклический аналог – бутадиен-1,3
имеющий в цикле 4 π-электрона, значительно менее устойчив, чем его ациклический аналог – бутадиен-1,3 -
Повышенной термодинамической стабильностью (ароматичностью) обладают циклические сопряженные системы, которые имеют плоское строение
Плоское строение цикла, состоящего из sp2-атомов, является условием образования замкнутой
π-электронной системы сопряжения за счёт бокового перекрывание р-АО соседних атомов. и содержат в замкнутой цепи сопряжения(4n + 2) π-электронов, где n – целое число: 0, 1, 2 и т.д. - Циклы, содержащие 4n (n = 1, 2, 3...) π-электронов, антиароматичны (дестабилизированы).

Другие моноциклические сопряженные соединения с числом π-электронов, отличным от шести (n = 2, 3 и т.д.), менее устойчивы, чем 6 π-электронная система.
Это обусловлено нарушением плоского строения цикла, что приводит к снижению эффективности бокового перекрывания р-орбиталей и, следовательно, к уменьшению степени делокализации π-электронов. Пример: цикл C10H10.Циклодекапентаен-1,3,5,7,9
(формула 4n + 2 при n = 2)

10-членный цикл имеет неплоское строение вследствие
электронного отталкивания противостоящих С–Н-связей.
Полициклические конденсированные арены, имеющие плоское строение, также соответствуют критериям ароматичности по формуле4n + 2 , если они не содержат атомов, являющихся общими более чем для двух циклов: нафталин, антрацен и т.п.
и т.п.
(формула 4n + 2 при n = 2)

10-членный цикл имеет неплоское строение вследствие
электронного отталкивания противостоящих С–Н-связей.
Полициклические конденсированные арены, имеющие плоское строение, также соответствуют критериям ароматичности по формуле
 и т.п.
и т.п.Примером антиароматического соединения служит циклобутадиен
 C4H4, содержащий 4 π-электрона (формула 4n при
C4H4, содержащий 4 π-электрона (формула 4n при
Правило Хюккеля применимо также для оценки относительной стабильности сопряженных ионов
Ароматичность и антиароматичность ионов
Согласно правилу Хюккеля, простейшая ароматическая система должна содержать два π-электрона по формуле 4n + 2 при n=0. Такой системой является циклопропенил-катион, в трёхчленном цикле которого находятся 2 π-электрона. Ароматичность этого катиона проявляется в большей устойчивости по сравнению с катионом аллильногоCH2=CH–CH2–
группа аллил типа-CH=CH–CH+- (или -[CH...CH...CH]+-), имеющим открытую цепь сопряжения.

-CH=CH–CH–- (или -[CH...CH...CH]–-).
Подобные ионы могут возникать как промежуточные частицы (интермедиаты) в ходе ионных реакций. Известно, что реакция идёт через образование наиболее устойчивых интермедиатов (часть I. Роль промежуточных частиц). Поэтому при электрофильном присоединении по кратной связи более вероятно участие катионов циклической формы. При нуклеофильном присоединении, напротив, преимущественно образуются анионы с открытой цепью сопряжения. Для 5-членных циклических ионов соотношение иное: циклопентадиенил-анион ароматичен, так как содержит в системе сопряжения 6 электронов (формула4n + 2 при n=1), а циклопентадиенил-катион, имеющий 4π-электрона, — антиароматичен (формула 4n при n=1).

4n+2 или 4n) и являются неароматическими сопряжёнными системами. В этом случае циклические и ациклические системы сопряжения примерно равноценны по устойчивости.
группа аллил типа

Подобные ионы могут возникать как промежуточные частицы (интермедиаты) в ходе ионных реакций. Известно, что реакция идёт через образование наиболее устойчивых интермедиатов (часть I. Роль промежуточных частиц). Поэтому при электрофильном присоединении по кратной связи более вероятно участие катионов циклической формы. При нуклеофильном присоединении, напротив, преимущественно образуются анионы с открытой цепью сопряжения. Для 5-членных циклических ионов соотношение иное: циклопентадиенил-анион ароматичен, так как содержит в системе сопряжения 6 электронов (формула

 Циклопентадиенил-анион образует с ионами переходных металлов устойчивые π-комплексы — металлоцены, имеющие "сэндвичевую" структуру.
Наиболее известным представителем этого класса металлоорганических соединений является ферроцен Fe(C5H5)2, образующийся путём перекрывания связывающих π-МО анионов [C5H5]– с вакантными 3d-АО иона Fe2+.
Циклопентадиенил-анион образует с ионами переходных металлов устойчивые π-комплексы — металлоцены, имеющие "сэндвичевую" структуру.
Наиболее известным представителем этого класса металлоорганических соединений является ферроцен Fe(C5H5)2, образующийся путём перекрывания связывающих π-МО анионов [C5H5]– с вакантными 3d-АО иона Fe2+.Ферроцен термически стабилен до 450°C, не разлагается при кипячении с водными растворами HCl и NaOH. Это устойчивое вещество используется как антидетонационная присадка к моторным топливам (более безопасная, чем тетраэтилсвинец), добавляется в моторные масла для улучшения их качества. Ферроцен и его производные находят применение в фармакологии, в химии полимеров и др. |








