Галогенирование алканов – реакция замещения одного или более атомов водорода в молекуле алкана на галоген. Продукты реакции называют галогеналканами или галогенопроизводными алканов. Активность галогенов в этой реакции уменьшается в ряду: F > Cl > Br > I. Взаимодействие алканов с хлором и бромом идет на свету или при нагревании. В этих условиях фтор реагирует очень бурно (со взрывом), а реакция с йодом проходит только в присутствии окислителя (для удаления НI). Практическое значение имеет реакция хлорирования метана:




Галогенирование алканов протекает по радикальному цепному механизмуРадикальный механизм реакции – химическое превращение, протекающее с гомолитическим разрывом ковалентной связи, образованием промежуточных частиц свободнорадикального типа и возникновением новой связи по обменному механизму., то есть как цепь последовательных превращений с участием свободно-радикальных частиц. В разработке теории цепных реакций важную роль сыграли труды академика, лауреата Нобелевской премии Н.Н. Семенова.
Механизм радикального замещения (символ SR) на примере монохлорирования метана: CH3Cl + HCl
CH3Cl + HCl• анимация II с аудио комментарием (742 Кб)
Стадия 1 – зарождение (инициирование) цепи – появление в зоне реакции свободных радикалов. Под действием световой энергии гомолитическиГомолитическим называется разрыв ковалентной связи, при котором каждый атом получает по одному электрону из общей пары. Частицы, образуюшиеся при таком разрыве связи, представляют собой свободные радикалы (частицы с неспаренным электроном). разрушается связь в молекуле Cl:Cl на два атома хлора с неспаренными электронами (свободные радикалы) •Cl:


 CH3Cl + H• не идет, так как энергия
CH3Cl + H• не идет, так как энергияатомарного водорода H• значительно выше, чем метильного радикала •СН3.

и так далее...

В реакциях хлорирования и бромирования алканов с вторичными или третичными атомами углерода легче всего идет замещение водорода у третичного атома, труднее у вторичного и еще труднее у первичного. Это объясняется большей устойчивостью третичных и вторичных углеводородных радикалов по сравнению с первичными вследствие делокализации неспаренного электрона (Часть I. Роль промежуточных частиц).


Подробнее
Направление реакций замещения. В случае метана и этана при замещении одного атома водорода образуется один продукт, так как все связи С–Н в этих молекулах равноценны. В реакциях замещения в пропане и других алканах, содержащих вторичные и третичные атомы углерода (наряду с первичными), возможны различные направления реакции с образованием изомерных продуктов.
Например, реакция бромирования пропана может идти по двум направлениям – I и II:

Можно считать, что реакция преимущественно будет идти в направлении II – через образование более устойчивого вторичного радикала •CH(CH3)2. И действительно, 2-бромпропана образуется
Хлор как более активный реагент действует менее избирательно.
 Видеоопыт "Взаимодействие алканов с бромом при нагревании".
Видеоопыт "Взаимодействие алканов с бромом при нагревании".На алканы действует pазбавленная азотная кислота пpи нагpевании и давлении. В pезультате пpоисходит замещение атома водоpода на остаток азотной кислоты – нитpогpуппу NO2. Эту pеакцию называют pеакцией нитpования, а пpодукты pеакции – нитроалканами (нитpосоединениями).
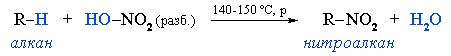
Подробнее
Нитрование предельных углеводородов азотной кислотой представляет собой цепной процесс, протекающий по механизму свободнорадикального замещения (SR).
При нагревании азотная кислота разлагается с выделением диоксида азотаСистематическое название NO2 — оксид азота (IV). NO2:
 4NO2 + 2H2O + O2
4NO2 + 2H2O + O2В обычном состоянии NO2 существует в равновесии со своим димером N2O4:
2NO2
 N2O4
N2O4При ~140 °C это равновесие практически полностью сдвинуто в сторону NO2.
Во избежание реакций окисления используется разбавленная азотная кислота.
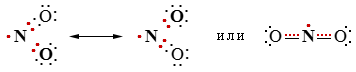 NO2
NO2Диоксид азота 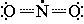 (или •NO2), обладая неспаренным электроном, является свободнорадикальной частицей и способен инициировать цепной радикальный процесс. Под его действием в молекуле углеводорода гомолитически
(или •NO2), обладая неспаренным электроном, является свободнорадикальной частицей и способен инициировать цепной радикальный процесс. Под его действием в молекуле углеводорода гомолитически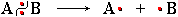
Гомолитический разрыв
ковалентной связи разрывается связь
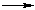 HNO2 + R•
HNO2 + R•Азотистая кислота при взаимодействии с азотной кислотой снова дает диоксид азота, который далее развивает цепь превращений.
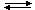 2(•NO2) + H2O
2(•NO2) + H2O Обрыв цепи (деактивация радикальных частиц) происходит при взаимодействии свободных радикалов R• и •NO2, между которыми возникает ковалентная связь (обменный механизм) с образованием конечного продукта — нитросоединения:
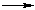 R–NO2
R–NO2Возможна также параллельная реакция присоединения R• к диоксиду азота по атому кислорода, приводящая к изомерному продукту – нитриту (эфиру азотистой кислоты):
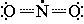
 R–O–N=O
R–O–N=O
Кроме того, в цепном процессе протекают побочные реакции образования нитрозосоединений  •NO + •NO2 + H2O
•NO + •NO2 + H2O
R• + •NO  R–N=O
R–N=O
При нитровании алканов также соблюдается порядок реакционной способности С–Н-связей, характерный для реакций радикального замещения. Например, в пропане преимущественно замещается водород при вторичном атоме углерода:
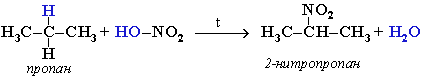
 R–SO2Cl + HCl
R–SO2Cl + HClR–H + 2SO2 + O2 + H2O (hν)
 R–OSO2H + H2SO4
R–OSO2H + H2SO4 Подробнее
Сульфохлорирование и сульфоокисление алканов происходят по свободнорадикальному механизму и используются для получения сульфокислот, применяемых в синтезе поверхностно-активных веществ. Практическое значение имеют реакции алканов C12 и выше.
При сульфохлорировании на алканы действуют сернистым ангидридом и хлором при облучении, что приводит к замещению водорода на хлорсульфонильную группу и образованию алкансульфохлоридов:

Стадии процесса:
Осторожным гидролизом алкансульфохлоридов получают алкансульфокислоты
 R–SO2–OH + HCl,
R–SO2–OH + HCl,а в избытке щёлочи образуются соли алкансульфокислот (алкансульфонаты).

Сульфоокисление проводится при одновременном действии на алканы диоксида серы и кислорода при ультрафиолетовом облучении или в присутствии инициаторов цепного процесса – веществ, легко распадающихся на свободные радикалы (например, пероксидов, озона и т.п.).








 Советский физик и физико-химик, акад. АН СССР (с 1932 г.). Родился в Саратове. Окончил Петроградский университет (1917). В 1918-1920 работал в Томском университете, в 1920-1931 - в Петроградском (Ленинградском) физико-техническом институте, одновременно с 1928 профессором Ленинградского политехнического института. С 1931 директор Института химической физики АН СССР, одновременно с 1944 профессор Московского университета. В 1963-1971 вице-президент АН СССР. Главный редактор журнала "Химическая физика" (с 1981). Председатель правления Всесоюзного общества "Знание" (1960-1963). Член многих академий наук и научных обществ. Дважды Герой Социалистического Труда (1966,1976). Государственные премии СССР (1941, 1949), Ленинская премия (1976), Нобелевская премия (1956, совместно с С.Н. Хиншелвудом).
Советский физик и физико-химик, акад. АН СССР (с 1932 г.). Родился в Саратове. Окончил Петроградский университет (1917). В 1918-1920 работал в Томском университете, в 1920-1931 - в Петроградском (Ленинградском) физико-техническом институте, одновременно с 1928 профессором Ленинградского политехнического института. С 1931 директор Института химической физики АН СССР, одновременно с 1944 профессор Московского университета. В 1963-1971 вице-президент АН СССР. Главный редактор журнала "Химическая физика" (с 1981). Председатель правления Всесоюзного общества "Знание" (1960-1963). Член многих академий наук и научных обществ. Дважды Герой Социалистического Труда (1966,1976). Государственные премии СССР (1941, 1949), Ленинская премия (1976), Нобелевская премия (1956, совместно с С.Н. Хиншелвудом).

