Химические свойства алканов
- Химические свойства любого соединения определяются его строением, то есть природой входящих в его состав атомов и характером связей между ними.

Во-первых, предельная насыщенность алканов не допускает реакций присоединения, но не препятствует реакциям разложения, изомеризации и замещения (часть I. Классификация реакций по конечному результату). Во-вторых, симметричность неполярных С–С и слабополярных С–Н ковалентных связей (см. в таблице значения дипольных моментов) предполагает их гомолитический
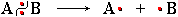
Гомолитический разрыв
ковалентной связи
Для радикальных реакций требуются определенные условия: повышенная температура (часто реакцию проводят в газовой фазе); действие света или радиоактивного излучения; неполярные растворители; в некоторых случаях необходимо присутствие инициаторов – источников активных свободных радикалов. Следует также отметить отрицательную роль кислорода, который замедляет (ингибирует) радикальный процесс и снижает выход конечных продуктов. Это связано с тем, что бирадикальные молекулы кислорода •ОО• , взаимодействуя с активными радикалами R•, образуют малоактивные частицы RОО•. Поэтому радикальные реакции (кроме реакций окисления кислородом) для повышения их эффективности проводят без доступа воздуха.
, взаимодействуя с активными радикалами R•, образуют малоактивные частицы RОО•. Поэтому радикальные реакции (кроме реакций окисления кислородом) для повышения их эффективности проводят без доступа воздуха.
 , взаимодействуя с активными радикалами R•, образуют малоактивные частицы RОО•. Поэтому радикальные реакции (кроме реакций окисления кислородом) для повышения их эффективности проводят без доступа воздуха.
, взаимодействуя с активными радикалами R•, образуют малоактивные частицы RОО•. Поэтому радикальные реакции (кроме реакций окисления кислородом) для повышения их эффективности проводят без доступа воздуха.
Поскольку гетеролитический разрыв связей С–С и С–Н в обычных условиях не происходит, то в ионные реакции алканы практически не вступают. Это проявляется в их устойчивости к действию полярных реагентов (кислот, щелочей, окислителей ионного типа: КMnO4, К2Сr2O7 и т.п.). Такая инертность алканов в ионных реакциях, идущих при невысокой темпратуре, и послужила ранее основанием считать их неактивными веществами и назвать парафинамиот лат. parum affinis – имеющий мало сродства, малоактивный..
 Видеоопыт "Отношение метана к раствору перманганата калия и бромной воде".
Видеоопыт "Отношение метана к раствору перманганата калия и бромной воде".- c разрывом связей С–С происходят реакции разложения (крекинг алканов) и реакции изомеризации углеродного скелета;
- по связям С–Н возможны реакции замещения атома водорода или его отщепления (дегидрирование алканов);
- атомы углерода в алканах находятся в наиболее восстановленной формеСтепень окисления углерода, например, в метане равна –4, в этане
–3 и т.д. и в присутствии окислителей в определенных условиях могут происходить реакции окисления с участием связейС–С и С–Н.








