Введение заместителя в бензольное кольцо происходит по механизму электрофильного замещения SЕ (от англ. Substitution Electrophilic).
C6H6 + X+ Y–
 C6H5X + HY,
C6H5X + HY,Примеры электрофильных частиц:
Cl+, Br+, NO2+, SO3, CH3+, RC+=O и т.п. образующийся в ходе реакции при помощи катализатора, который поляризует связь
 X+ + :Y–
X+ + :Y–:Y– — нуклеофильный остаток, связывающий вытесненный из бензола протон Н+.
- Механизм электрофильного замещения
Механизм электрофильного замещения в ароматических соединениях включает ряд стадий:

II стадия (лимитирующая): образование σ-комплекса. Два электрона из π-системы идут на образование σ-связиС–Х. При этом ароматичность кольца нарушается. Атом углерода, соединившись с электрофилом Х, переходит из sp2 в sp3-гибридизованное состояние и выходит из системы сопряжения. В системе сопряжения остаются 4 π-электрона, которые делокализованы на 5-ти углеродных атомах кольца (заряд +1). Распределение положительного заряда в карбокатионе σ-комплекса отражает набор из 3-х граничных (резонансных) структур или одна структура с делокализованными связями:
Изменение энергии в ходе реакции 
Галогенирование. Замещение атома водорода в бензольном кольце на галоген происходит в присутствии катализаторов AlCl3, AlBr3, FeCl3 и т.п. (кислот Льюиса):


 Видеоопыт "Бромирование бензола".
Видеоопыт "Бромирование бензола".Нитрование. Бензол реагирует с нитрующей смесью (смесью концентрированных азотной и серной кислот), образуя нитробензол:

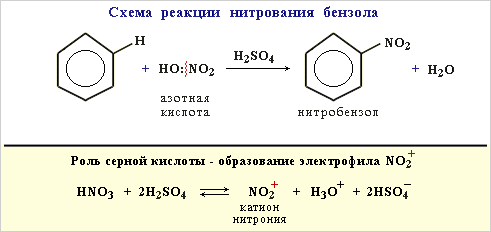
Интерактивная анимация
 Видеоопыт "Нитрование бензола".
Видеоопыт "Нитрование бензола".Сульфирование. В реакции с "дымящей" серной кислотой (конц. H2SO4+SO3) атом водорода в бензольном кольце замещается на сульфогруппу
Подробнее
При действии на бензол дымящей серной кислоты

При обработке бензолсульфоновой кислоты перегретым водяным паром (выше 100 oC) происходит реакция десульфирования (удаление сульфогруппы):
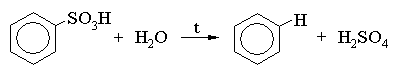
Алкилирование. Замещение атома водорода в бензольном кольце на алкильную группу (алкилирование) происходит под действием алкилгалогенидов (реакция Фриделя-Крафтса) или алкенов в присутствии катализаторов AlCl3, AlBr3, FeCl3 (кислот Льюиса).



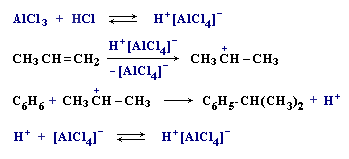
Ацилирование.
Для введения ацильной группы –CR=O в бензольное кольцо реакцию проводят с галогенангидридамиГалогенангидриды карбоновых кислот RCOOH — производные кислот, в которых гидроксильные группы заменены атомами галогена RCOHal, чаще RCOCl. (ацилгалогенидами) RCOCl или ангидридамиАнгидриды карбоновых кислот RCOOH – продукты (RCO)2O, образующиеся при отщеплении одной молекулы воды от двух молекул кислоты. (RCO)2O
карбоновых кислот в присутствии катализаторов Фриделя-Крафтса (AlCl3, BF3 и т.п). Продуктами реакции являются кетоны (алкиларилкетоны); в приведённом примере — метилфенилкетон (ацетофенон):










