Строение молекул алканов
Строение алканов определяет их химические и физические свойства. Поэтому для понимания свойств этих соединений необходимо иметь представление о
химическом и
пространственном строении их молекул.
- Химическое строение вещества – это порядок соединения атомов в его молекулах, который отражается с помощью структурных формул.
- Пространственное строение – взаимное расположение атомов молекулы в трехмерном пространстве. Для изображения пространственного строения молекул используют стереохимическиеСтереохимические формулы - структурные формулы с внесенными в них элементами, отражающими пространственное располо-жение атомов. Связь, лежащую в плоскости рисунка, изображают простой линией; связь, расположенную над этой плоскостью, - жирным клином, а уходящую за плоскость - штрихованным клином. и проекционныеПроекционные формулы представляют собой проекции положения атомов молекулы с определенной точки зрения наблюдателя. формулы, а также молекулярные модели.
Химическое строение (порядок соединения атомов в молекулах) простейших алканов – метана, этана и пропана – показывают их
структурные формулы.Развёрнутые структурные формулы алканов

Из этих формул видно, что в алканах имеются два типа химических связей:
С–С и С–Н.
Связь С–С является ковалентной неполярной. Связь С–Н ковалентная слабополярная, так как углерод и водород близки по электроотрицательности (2.5 для углерода и 2.1 для водорода). Образование ковалентных связей в алканах за счет общих электронных пар атомов углерода и водорода можно показать с помощью
электронных формул:

Электронные и структурные формулы отражают
химическое строение, но не дают представления о
пространственном строении молекул, которое
существенно влияет на свойства вещества.
Пространственное строение, то есть взаимное расположение атомов молекулы в пространстве, зависит от направленности атомных орбиталей (АО) этих
атомов. В углеводородах главную роль играет пространственная ориентация атомных орбиталей углерода, поскольку сферическая 1s-АО атома водорода лишена определенной направленности.
Пространственное расположение АО углерода в свою очередь зависит от типа его гибридизации
(часть I, Гибридизация АО). Насыщенный атом углерода в алканах связан с четырьмя другими атомами. Следовательно, его состояние соответствует sp
3-гибридизации
(часть I, sp3-Гибридизация). В этом случае каждая из четырех sp
3-гибридных АО углерода участвует в осевом (σ-) перекрывании с s-АО водорода или с sp
3-АО другого атома углерода, образуя σ-связи С–Н или С–С.
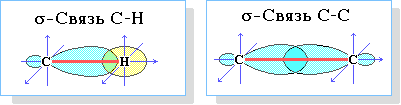
Четыре σ-связи углерода направлены в пространстве под углом 109
о28', что соответствует наименьшему отталкиванию электронов.
Поэтому молекула простейшего представителя алканов – метана СН
4 – имеет форму тетраэдра, в центре которого находится атом углерода, а в вершинах – атомы водорода:

Валентный угол Н–С–Н равен 109о28'.
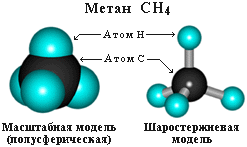
Пространственное строение метана можно показать с помощью объемных (масштабных) и шаростержневых моделей.
Для записи удобно использовать пространственную (стереохимическую) формулу.

Построение стереохимической формулы
В молекуле следующего гомолога – этана
С2Н6 – два тетраэдрических
sp3-атома углерода образуют более сложную пространственную конструкцию:

Анимация
Для молекул алканов, содержащих свыше 2-х атомов углерода, характерны
изогнутые формы. Это можно показать на примере
н-бутана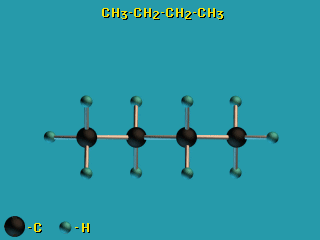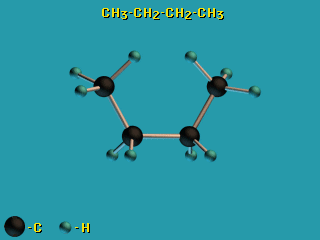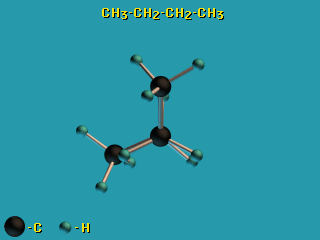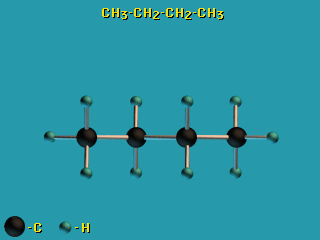 C4H10
C4H10 (
VRML-модель) или
н-пентана:

Анимация
 Из этих формул видно, что в алканах имеются два типа химических связей:
Из этих формул видно, что в алканах имеются два типа химических связей:








 C4H10
C4H10









