Энергия атомных орбиталей
ЭнергияЭнергия (от греч. ενέργεια - действие, активность, сила, мощь) — одно из основных свойств материи, способность к движению и совершению работы. (E) атомной орбитали (АО) характеризует прочность связывания электронаЧем выше энергия АО, тем слабее удерживается электрон в этом состоянии. с ядром атома и определяет положение этой АО в структуре многоэлектронной оболочки. Энергия АО может быть как рассчитана, исходя из уравнения Шрёдингера
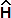 Ψ),
Ψ),- Энергия АО возрастает по мере удаления электрона от ядра атома, то есть с увеличением номера энергетического уровня, который характеризуется главным квантовым числом n.
-
Энергетический уровень с номером n имеет равное n число подуровней, отличающихся значением орбитального квантового числа ℓ (s, p, d и т.д.)
Энергетические уровни (n) и подуровни (nℓ) электронной оболочки
в атомах элементов 3-го периода
Число АО (занятых электронами и/или вакантных) на nℓ-подуровне равно 2ℓ + 1.
Cледовательно, суммарное количество АО на n-уровне составляет: Энергия АО на подуровнях одного n-уровня тем выше, чем больше
орбитальное число ℓ:
Число ℓ характеризует форму АО, так как зависит от амплитуды волновой
Энергия АО на подуровнях одного n-уровня тем выше, чем больше
орбитальное число ℓ:
Число ℓ характеризует форму АО, так как зависит от амплитуды волновой - В общем случае энергия АО определяется значениями как главного, так и орбитального квантовых чисел (правило Клечковского):
- Энергия АО тем выше, чем больше величина суммы главного и орбитального квантовых чисел (n+ℓ).
- При одинаковой сумме (n+ℓ) более низкой энергией обладает орбиталь с меньшим значением n
АО 3s 3p 4s 3d 4p n+ℓ 3+0 = 3 3+1 = 4 4+0 = 4 3+2 = 5 4+1 = 5 —— Увеличение энергии АО 
-
Энергия атомных орбиталей определяет строение электронной оболочки, окружающей ядро атома (схема).
энергия связанного электрона, в частности электрона в атоме, может принимать только вполне определенные значения.
Так, энергия s-АО увеличивается в ряду: 1s < 2s < 3s и т.д. (цифры соответствуют числу n).
Аналогично изменяется энергия р-АО: 2p < 3p < 4p и т.п.
каждому значению главного квантового числа отвечает определенное значение энергии электрона.
Чем выше ℓ, тем больше узлов и тем выше энергия орбиталей данного подуровня.
ℓ=0 (s-АО) - нет узловых поверхностей;
ℓ=1 (p-АО) - одна узловая плоскость;
ℓ=2 (d-АО) - две узловых плоскости и т.д.
Например, значениям n=2 и ℓ=1 соответствуют три АО на 2р-подуровне: 2px, 2py, 2pz.
Равные по энергии орбитали 2px, 2py, 2pz отличаются значениями магнитного квантового числа m (–1, 0, +1) и имеют разную пространственную ориентацию.

Равные по энергии орбитали 2px, 2py, 2pz отличаются значениями магнитного квантового числа m (–1, 0, +1) и имеют разную пространственную ориентацию.
Квантовый слой и, соответственно, энергетический уровень — это совокупность орбиталей с одинаковым главным квантовым числом.
В соответствии с разрешенными (дискретными, квантовыми) значениями энергий орбиталей электронную оболочку атома составляют
электронные квантовые слои
Энергия орбиталей внешнего электронного уровня с более подвижными электронами определяет способность атомов:
- переходить из основного в возбуждённое
состояние за счёт переноса электрона с более низкой по энергии АО на более высокую
Состояния атома углерода C (атомный номер элемента 6) 
- отдавать электрон и превращаться в катион при соответствующей энергии ионизации, Энергия ионизации — энергия, необходимая для отрыва электрона от атома, находящегося в основном состоянии.
- присоединять электрон с образованием аниона, проявляя сродство к электрону.Сродство к электрону — энергия, выделяющаяся при присоединении электрона к атому.
Среднее арифметическое значений энергии ионизации атома и его сродства к электрону Малликен предложил использовать как количественную характеристику электротрицательности элемента (шкала Малликена).
В зависимости от условий и природы атома перенос электрона e– может происходить с преобладанием одного из направлений:

Заполнение орбиталей электронами происходит последовательно от низшего энергетического уровня к высшему с соблюдением ряда правил.








