Основным способом получения нитросоединений является нитрованиеНитрование — реакция введения нитрогруппы -NO2 в органическое соединение. углеводородов и их производных (по углеводородному радикалу) под действием азотной кислоты HNO3. Условия реакции зависят от строения исходного соединения.
- Предельные углеводороды образуют нитросоединения при радикальном замещении атома водорода на нитрогруппу (реакция Коновалова):
- Нитропроизводные ароматических соединений получают путем электрофильного замещения водорода в бензольном ядре:
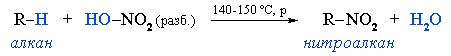
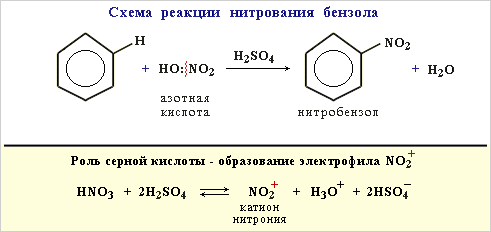
Механизм реакции
При нагревании азотная кислота разлагается с выделением диоксида азотаСистематическое название NO2 — оксид азота (IV). NO2:
 4NO2 + 2H2O + O2
4NO2 + 2H2O + O2В обычном состоянии NO2 существует в равновесии со своим димером N2O4:
2NO2
 N2O4
N2O4При ~140 °C это равновесие практически полностью сдвинуто в сторону NO2.
Во избежание реакций окисления используется разбавленная азотная кислота.
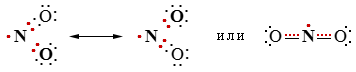 NO2
NO2Диоксид азота 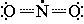 (или •NO2), обладая неспаренным электроном, является свободнорадикальной частицей и способен инициировать цепной радикальный процесс. Под его действием в молекуле углеводорода гомолитически
(или •NO2), обладая неспаренным электроном, является свободнорадикальной частицей и способен инициировать цепной радикальный процесс. Под его действием в молекуле углеводорода гомолитически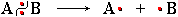
Гомолитический разрыв
ковалентной связи разрывается связь
 HNO2 + R•
HNO2 + R• 2(•NO2) + H2O
2(•NO2) + H2O 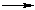 R–NO2
R–NO2-
Возможна также параллельная реакция присоединения радикала R• к диоксиду азота по атому кислорода, приводящая к изомерному продукту – нитриту (эфиру азотистой кислоты):
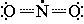
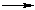 R–O–N=O
R–O–N=OКроме того, в цепном процессе протекают побочные реакции образования нитрозосоединений 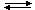 •NO + •NO2 + H2O
•NO + •NO2 + H2O
R• + •NO 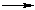 R–N=O
R–N=O

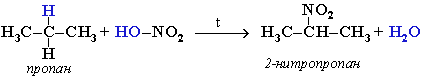
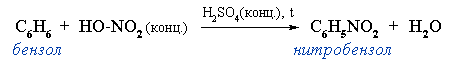
Схема реакции
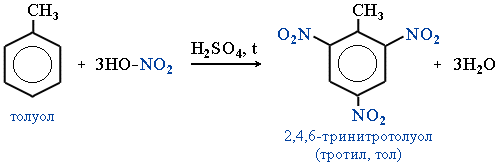
Например, тротиловый эквивалент атомной бомбы, сброшенной на Хиросиму, составил 13-18 килотонн.
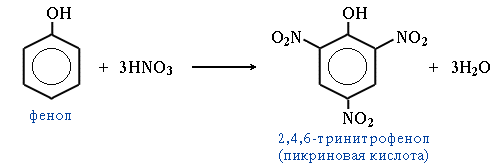
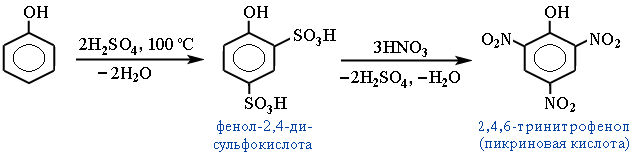
Ещё легче происходит нитрование фенола (фенольный гидроксил активирует бензольное кольцо за счёт +М-эффекта). При действии 20%-ной азотной кислоты и низкой температуре (0–5 °C) получают смесь 2- и 4-нитрофенолов. С концентрированной азотной кислотой образуется 2,4,6-тринитрофенол (пикриновая кислота):







 Русский химик-органик. Ученик В.В. Марковникова. Родился в деревне Булухино (ныне Ярославской обл.). Окончил Московский университет (1884). Работал там же (1884-1896), в 1896-1899 профессор Московского сельско-хозяйственного института, с 1899 профессор Киевского политехнического института (в 1902-1904 ректор).
Русский химик-органик. Ученик В.В. Марковникова. Родился в деревне Булухино (ныне Ярославской обл.). Окончил Московский университет (1884). Работал там же (1884-1896), в 1896-1899 профессор Московского сельско-хозяйственного института, с 1899 профессор Киевского политехнического института (в 1902-1904 ректор).
