Источники соединений азота
Азот – один из важнейших химических элементов, который наряду с углеродом, водородом и кислородом входит в состав различных органических соединений и определяет их свойства.
Основные природные запасы азота сконцентрированы в атмосфере, где его содержание достигает 79% (по объему). Другой природный источник азота – ископаемые минералы (селитры)Селитры — минералы (от позднелатинского minera – руда), содержащие щелочные, щелочноземельные и аммониевые соли азотной кислоты (нитраты). – к настоящему времени практически исчерпан. Поэтому весьма актуальна проблема использования атмосферного азота, который существует преимущественно в виде прочно связанных молекул N2.Азот в молекулярной форме исключительно инертен и в обычных условиях не способен к образованию связей с другими элементами (и поэтому часто используется как инертный газ). Только в жестких условиях на высокоэнергоёмких производствах при высокой температуре и большом давлении азот взаимодействует с водородом, образуя аммиак.Синтез аммиака: N2 + 3H2
 2NH3 проводится при температуре 500-550°C, давлении 15-30 МПа, катализатор Fe, активированный оксидами К2О, Аl2О3, СаО. Основным источником водорода служит паровая конверсия метана из природного газа:
2NH3 проводится при температуре 500-550°C, давлении 15-30 МПа, катализатор Fe, активированный оксидами К2О, Аl2О3, СаО. Основным источником водорода служит паровая конверсия метана из природного газа:CH3 + H2O (Ni, t, p)
 CO + 3H2
CO + 3H2 Синтез аммиака из атмосферного азота и водорода относится к важнейшим достижениям науки, открывшем промышленную химию азотсодержащих соединений.
Впервые эта реакция была проведена Ле Шателье (1901 г.). Позднее (1904-1907) В. Оствальд, В. Нернст и Ф. Габер изучали физико-химические условия её протекания. В 1909 г. Ф. Габер получил аммиак, применив разработанную технологию процесса, который стал называться его именем – процесс Габера (Нобелевская премия, 1918 г.).
С химической точки зрения, аммиак – предшественник других азотсодержащих соединений. На его основе получают азотную кислоту HNO3 для производства нитратов, нитросоединений (азотные удобрения, взрывчатые вещества и др.). Аммиак образует различные аминопроизводные:
амины, амиды, аминоспирты, аминокислоты, гетероциклические соединения и др. (красители, лекарственные средства, полимеры и т.п.).В природе главным источником соединений азота являются процессы азотфиксации и нитрификации. Эти процессы заключаются в образовании активных азотсодержащих веществ, которые участвуют в круговороте азота, необходимого для биосинтеза белков, нуклеиновых кислот и других природных соединений.
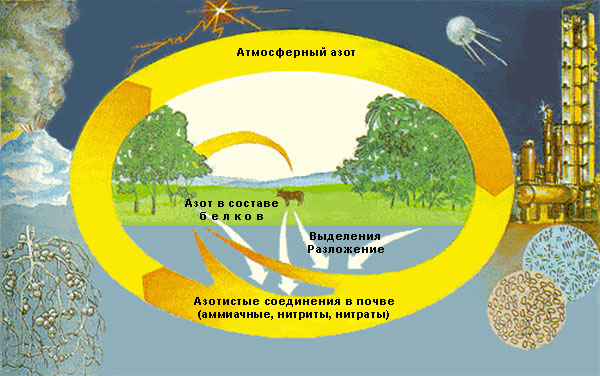
Азотфиксация – превращение атмосферного азота в связанные формы (аммиак, соединения аммония, оксиды азота), которые ассимилируются растениями и затем поступают в пищу животных и человека.
- К процессам природной азотфиксации относятся:
- жизнедеятельность сине-зеленых водорослей и азотфиксирующих бактерий в клубеньках бобовых растений;
- физические явления в атмосфере (грозовые разряды, излучение солнечной энергии, вулканическая деятельность), сопровождающиеся фотохимическими реакциями с образованием газообразных соединений азота (N2O, NO, NO2 и др.).
Нитрификация – бактериальное разложение в почве конечных продуктов обмена веществ в организмах и белков мертвых животных с образованием аммиака, аммониевых соединений [NH4]+X– (где X = OH, металл), нитритов (солей азотистой кислоты НNO2) и нитратов. (солей азотной кислоты НNO3).








