

| Формула | Название | Т пл. °C | Т кип. °C |
| H–CONH2 | Формамид | 2,5 | 210 |
| H–CONHCH3 | N-Метилформамид | – 4 | 182,6 |
| H–CON(CH3)2 | N,N-Диметилформамид | – 61 | 153 |
| CH3–CONH2 | Ацетамид | 82 | 221 |
| C6H5–CONH2 | Бензамид | 130 | 290 |
Амиды муравьиной кислоты: формамид
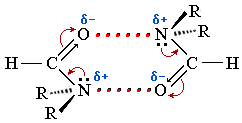
Низшие амиды хорошо растворимы в воде, благодаря способности к образованию гидратирующих водородных связей:

Химические свойства. Амиды — амфотерные вещества, обладающие слабо выраженными кислотными и осно́вными свойствами. Основность проявляется под действием сильных кислот за счёт присоединения протона (Н+) к карбонильному атому кислорода. Такое взаимодействие является основой кислотного катализа при гидролизе амидов — нуклеофильном замещении NH2-группы на ОН.
Первичные и вторичные амиды проявляют слабые
- Гидролиз амидов происходит в кислой или щелочной среде при нагревании с образованием, соответственно, карбоновой кислоты или её соли:
R–CONH2 + HCl (H2O) → R–COOH + NH4Cl Амиды более устойчивы к гидролизу по сравнению с другими производными карбоновых кислот. Этим объясняется широкое распространение амидных групп –C(O)–NH– в природных соединениях и синтетических полимерах (полиамидах).
R–CONH2 + NaOH (H2O) → R–COO–Na+ + NH3 - Под действием водоотнимающих реагентов (например, фосфорного ангидрида P2O5) из амидов образуются нитрилы:
- При восстановлении амиды превращаются в аминыАмины — органические производные аммиака, в молекуле которого один или несколько атомов водорода замещены на углеводородные радикалы:
RNH2, R2NH, R3N. :
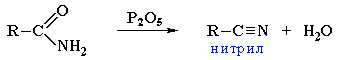
 R–CH2–NH2 + H2O
R–CH2–NH2 + H2O

 немецким ученым Вёлером (1828 г), который впервые доказал принципиальную возможность образования органических соединений из неорганических без участия "жизненной силы".
немецким ученым Вёлером (1828 г), который впервые доказал принципиальную возможность образования органических соединений из неорганических без участия "жизненной силы". Карбамид является ценным высококонцентрированным азотным удобрением (46,6% азота), которое используется на всех почвах и под все культуры. Как источник азота мочевину добавляют в корм скоту. Применяется также для получения карбамидных смол и лекарственных веществ (люминала, веронала и др.).
В промышленности амиды используются в качестве пластификаторов бумаги и искусственной кожи, для экстракции радиоактивных металлов, в качестве исходных соединений для синтеза полимеров, как промежуточные продукты в производстве красителей и сульфамидных препаратов.
Практическое значение имеют высокопрочные синтетические полиамиды: Полимеризацией акриламида CH2=CHCONH2 получают полиакриламид [–CH2–CH(CONH2)–]n — водорастворимый гелеобразующий полимер. Полиакриламид считается универсальным химическим веществом, которое применяется в качестве коагулянта в цветной металлургии, горно-добывающей и химической промышленности, а также для пропитки бумаги с целью увеличения ее прочности. Используется для закрепления нефтяных скважин. Полимер акриламида и его сополимеры с акриловой кислотой применяют как структурообразователи для укрепления грунтов.







 видео
видео
