Физические свойства аминов
Связь N–H является полярной, поэтому первичные и вторичные амины образуют межмолекулярные водородные связи (несколько более слабые, чем Н-связи с участием группы О–Н).

Это объясняет относительно высокую температуру кипения аминов по сравнению с неполярными соединениями со сходной молекулярной массой. Например:

Третичные амины не образуют ассоциирующих водородных связей (отсутствует группа N–H). Поэтому их температуры кипения ниже, чем у изомерных первичных и вторичных аминов (триэтиламин кипит при 89 °С, а н-гексиламин — при 133 °С).
По сравнению со спиртами алифатические амины имеют более низкие температуры кипения (т. кип. метиламина –6 °С, т. кип. метанола +64,5 °С). Это свидетельствует о том, что амины ассоциированы в меньшей степени, чем спирты, поскольку прочность водородных связей с атомом азота меньше, чем с участием более электроотрицательного кислорода.
При обычной температуре только низшие алифатические амины CH3NH2, (CH3)2NH и (CH3)3N — газы (с запахом аммиака), средние гомологи — жидкости (с резким рыбным запахом), высшие — твердые вещества без запаха. Ароматические амины — бесцветные высококипящие жидкости или твердые вещества.
Амины способны к образованию водородных связей с водой:
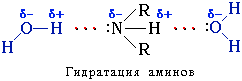
Поэтому низшие амины хорошо растворимы в воде. С увеличением числа и размеров углеводородных радикалов растворимость аминов в воде уменьшается, так как увеличиваются пространственные препятствия образованию водородных связей. Ароматические амины в воде практически не растворяются.
Все амины токсичны, особенно ароматические и некоторые из диаминов.Например, к группе так называемых "трупных ядов" (птомаинов) относятся тетраметилендиамин (путресцин) и пентаметилендиамин (кадаверин), образующиеся при гниении белков