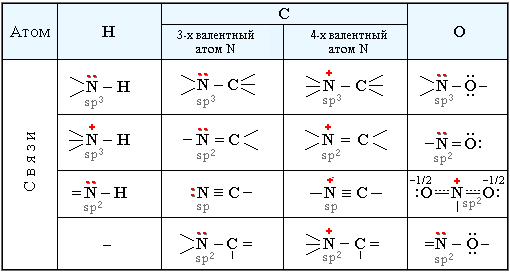
Строение и свойства соединений азота определяются характером его химических связей и типом гибридизации, влияющей на форму молекулы и электронные эффекты ее фрагментов.
На внешнем электронном уровне атом азота имеет три атомные орбитали, которые содержат по одному электрону, и одну АО, занятую двумя электронами. Три одноэлектронные АО азота могут участвовать в образовании трех ковалентных связей с другими атомами по обменному механизму.При обменном механизме образования ковалентной связи участвуют одноэлектронные атомные орбитали связываемых атомов, т.е. каждый из атомов предоставляет в общее пользование по одному электрону.
При этом азот проявляет валентность 3 и имеет неподеленную электронную пару (на четвертой АО). Такой атом может выступать донором пары электронов, образуя четвертую связь по донорно-акцепторному механизму:При донорно-акцепторном механизме образование связи происходит за счет перекрывания двухэлектронной атомной орбитали атома-донора и вакантной орбитали атома-акцептора.
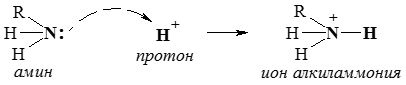
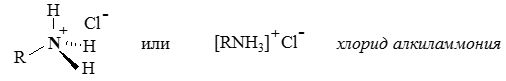
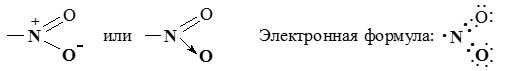
Из значений электроотрицательностей азота (3,0), водорода (2,1), углерода (2,5) и кислорода (3,5) следует, что связи азота с водородом, кислородом или углеродом являются ковалентными полярными.
В связях трехвалентного азота с углеродом или водородом электронная плотность смещена к более электроотрицательному атому азота, создавая на нем частичный отрицательный заряд (δ–), а на углероде или водороде – частичный положительный (δ+). Связи с четырехвалентным азотом, несущим положительный заряд, отличаются более высокой полярностью.
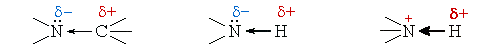
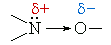
- Полярность связей азота с водородом, кислородом и углеродом способствует их гетеролитическому разрыву. Следовательно, реакции с участием этих связей будут происходить преимущественно по ионному механизму.
- Соединения, содержащие атом азота с неподеленной электронной парой, могут проявлять свойства оснований (присоединять протон) и нуклеофильных реагентов (отдавать электронную пару на связь с углеродом).
- Молекулы с полярными группами N–Н, способны к образованию водородных связей, от которых зависят физические свойства вещества .








