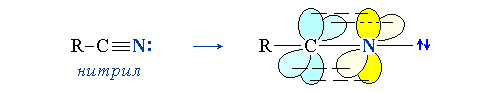 Азот (N) – элемент VА группы 2-го периода
Периодической системы элементов;
порядковый номер 7; атомная масса 14,01;
электроотрицательность 3,0.
Азот (N) – элемент VА группы 2-го периода
Периодической системы элементов;
порядковый номер 7; атомная масса 14,01;
электроотрицательность 3,0.
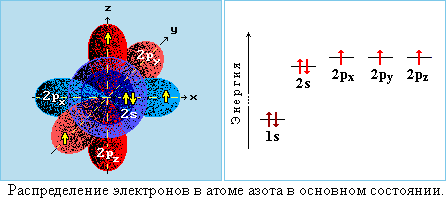
Электронная конфигурация в основном состоянии 1s22s22p3:
На внешнем (валентном) уровне 2s и 2p содержится 5 электронов, которые участвуют в образовании химических связей с другими атомами.
Подобно углероду, азот в различных соединениях может находиться в состояниях sp3-, sp2- или sp-гибридизации.
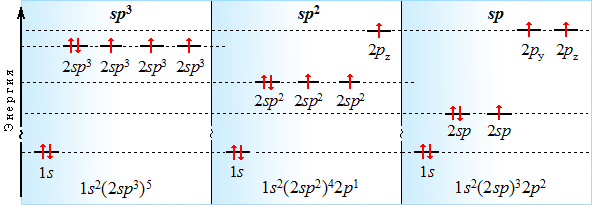
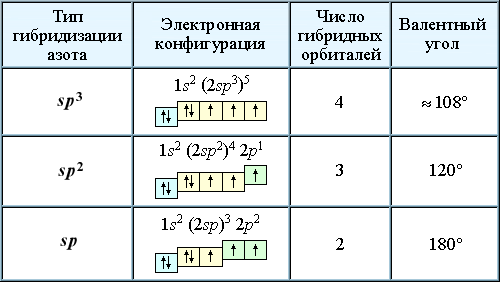
Строение соединений, содержащих атом азота в различных состояниях гибридизации, можно показать с помощью атомно-орбитальных моделей (построение АО-моделей).
1. sp3-Состояние атома азота характерно для аммиака, алифатических аминов и аммониевых ионов:
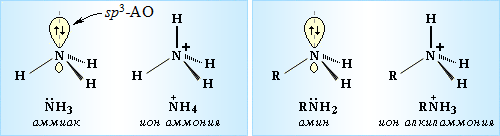
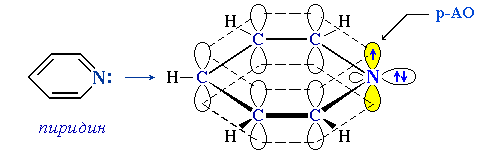
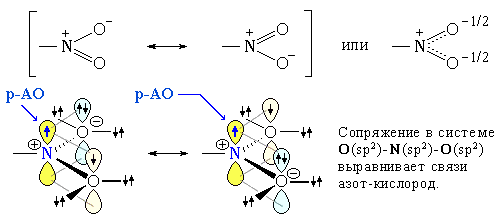
2. sp2-Атом азота содержат молекулы и атомные группы, в которых он связан с sp2-атомом углерода (или другого элемента). В этом случае негибридизованная р-орбиталь азота может иметь неподеленную пару электронов или один электрон, участвующий в образовании π-связи:
- • амиды карбоновых кислот
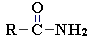
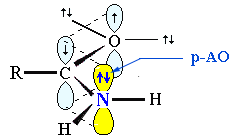
- • ароматические амины
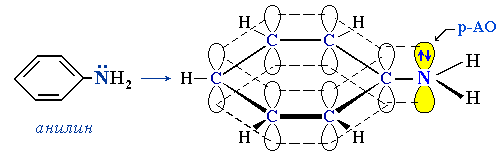
- • гетероциклы
- • нитрогруппа -NO2
3. sp-Атом азота входит в молекул нитрилов: