Угольная кислота H2CO3 — слабая двухосновная кислота, неустойчивое соединение, легко распадающееся на диоксид углерода и воду:
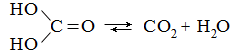
Угольная кислота образует два ряда производных — полные (средние) и неполные (кислые). Кислые производные нестабильны и разлагаются с выделением диоксида углерода. К наиболее важным производным угольной кислоты относятся:

Фосген COCl2 (полный хлорангидрид угольной кислоты) — газ (т.кип. 8,2 °C) с запахом прелого сена, очень ядовит, взывает отёк лёгких (применялся как боевое отравляющее вещество во время 1-ой мировой войны). В промышленности фосген получают радикальным хлорированием оксида углерода(II) над активированным углем:
 COCl2
COCl2Благодаря высокой реакционной способности, фосген используется для получения других производных угольной кислоты и как реагент в различных органических синтезах для введения группы С=О.
При взаимодействии фосгена со спиртами образуются сложные эфиры двух типов — неполные (хлоругольные эфиры) и полные (карбонаты):
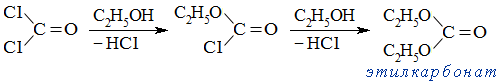
С двухатомными фенолами или спиртами фосген вступает в реакцию поликонденсации с образованием сложных полиэфиров — поликарбонатов, имеющих широкое практическое применение.
 [–O–R–O–CO–]n + 2nHCl
[–O–R–O–CO–]n + 2nHClВ реакции фосгена с первичными аминами RNH2 образуются изоцианаты:
 R–N=C=O + 2HCl
R–N=C=O + 2HCl  O=C=N–R–N=C=O + 4HCl
O=C=N–R–N=C=O + 4HCl
 [–CO–NH–R–NH–CO–O–R'–O–]n
[–CO–NH–R–NH–CO–O–R'–O–]n
Благодаря разнообразию механических свойств, полиуретаны различных типов применяются в качестве защитных покрытий, лакокрасочных изделий, клеев, герметиков, деталей машин, изоляторов, имплантатов, подошв обуви, спортивных шин и прочих изделий.
Карбамид (мочевина) CO(NH2)2 (полный амид угольной кислоты) — кристаллическое вещество белого цвета (т.пл. 132,7 °C), растворимое в полярных растворителях (воде, этаноле и т.п.).
Промышленный способ получения мочевины — взаимодействие аммиака с диоксидом углерода при повышенных давлении и температуре:
 NH2–CO–NH2 + H2O (реакция Базарова)
NH2–CO–NH2 + H2O (реакция Базарова)
Мочевина — крупнотоннажный продукт, используемый в основном как азотное удобрение. Другое важное промышленное применение мочевины — производство мочевино-формальдегидных смол для изготовления пенопласта, древесно-стружечных и древесно-волокнистых плит, фанеры, влагостойких сортов бумаги и картона.







