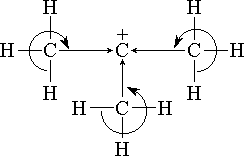
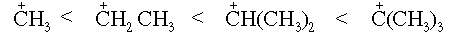Группа метил CH3 (в меньшей степени, CH2R и СHR2), связанная с sp2 или sp-атомом, проявляет слабый эффект электронной делокализации, называемый эффектом сверхсопряжения (или гиперконъюгации).
Этот эффект обусловлен перекрыванием σ-молекулярной орбитали связи С–Н-
- с π-молекулярной орбиталью кратной связи (σ, π-сопряжение):
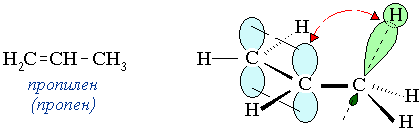
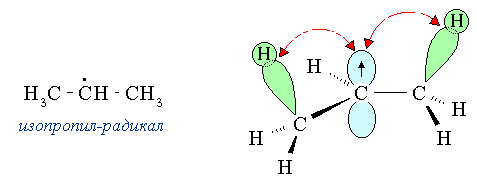
Графически эффект сверхсопряжения обозначается изогнутой стрелкой, охватывающей
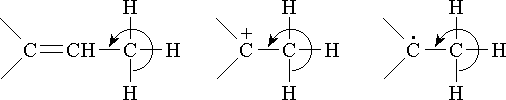
Направление стрелки показывает смещение σ-электронов связи С–Н в сторону кратной связи или р-АО. Таким образом, метильная группа при sp2- (или sp-) атоме проявляет электронодонорные свойства не только за счет +I-эффекта, но и в результате сверхсопряжения.
Хотя сверхсопряжение является слабым эффектом, его роль в стабилизации вторичных и, тем более, третичных свободных радикалов и катионов вследствие делокализации электронов весьма значительна.
Именно этим фактором, в частности, объясняется увеличение устойчивости свободных радикалов в ряду:
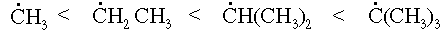
В той же последовательности возрастает устойчивость карбокатионов, которая обусловлена как +I-эффектом алкильных групп, так и эффектом сверхсопряжения: